За последние 20 лет произошли существенные изменения в эпидемиологической ситуации в отношении ИППП: инфекций, возбудители которых передаются преимущественно при половом контакте (ВОЗ, 1982 г.). Понимание того, что мы находимся в «разгаре» эпидемии вызвало огромный интерес к проблеме ИППП. От 5 «классических» инфекций: гонорея, сифилис, канкроид, лимфогранулема venereum, гранулема inguinale, их число значительно возросло и составляет более 20 (Приложение 1). Ежегодно в мире регистрируется более 250 млн. новых случаев ИППП: гонореи-25 млн., хламидийной инфекции-50 млн.
Следует также отметить особенности ИППП:
— Истинная распространенность многих из них неясна (сложности диагностики или учета заболеваемости)
— большинство инфекций протекает не тяжело и не угрожает жизни больного (исключение — ВИЧ инфекция)
— некоторые инфекции могут быть легко излечимы
— высокая распространенность инфекций, имеющая тенденцию к росту, риск тяжелых осложнений (бесплодие, внематочная беременность, рак шейки матки) определяет их медицинское и социальное значение
— заболеваемость является показателем полового поведения, повышающего риск ВИЧ инфицирования, а возбудители заболеваний, особенности их течения способствуют инфицированию ВИЧ.
Существует три уровня контроля ИППП:
1. Предупреждение контакта с возбудителем — первичная профилактика.
2. Выявление и лечение бессимптомных инфекций (предупреждение распространения)- вторичная профилактика.
3. Правильное лечение явных инфекций для предупреждения осложнений- третичная профилактика.
I. СТРЕПТОКОККИ ГРУППЫ » В «.
Стрептококки группы Б (СГБ) до 1964 г. не рассматривались как патоген человека. В последующие 30 лет СГБ были признаны основными бактериальными патогенами в перинатальных инфекциях, вытеснив кишечную палочку, как наиболее часто встречающийся микроорганизм, при бактериемии или менингите у новорожденных первых 2 месяцев жизни. В акушерстве с инфицированием СГБ связывают инфекции мочевых путей, амниониты, послеродовые эндометриты, бактериемию в родах и после них, преждевременное излитие вод и преждевременные роды.
Эпидемиология. СГБ являются частью нормальной флоры влагалища и могут быть обнаружены у 5-35% всех беременных. Бессимптомная колонизация влагалища встречается примерно у 20% женщин (4,6 — 40%). Наиболее высок уровень колонизации у женщин моложе 20 лет, имеющих высокую половую активность, использующих ВМС- контрацепцию: наиболее часто- вход во влагалище и наименее часто- шейка матки. Сам факт беременности не влияет на уровень колонизации. Наиболее надежно СГБ выявляются при использовании селективных питательных сред, лучшая — Тодда — Хевитта: бульон с кровью овец с добавлением налидиксовой кислоты и гентамицина. При использовании неселективной среды до 50% женщин, имеющих СГБ не будут идентифицированы.
Риск передачи новорожденному СГБ при инфицировании матери составляет 42-72%, а при отсутствии инфицирования — только 8%. Примерно 2/3 инфицированных новорожденных от матерей с СГБ будут бессимптомными носителями инфекции. Несмотря на высокий уровень вертикальной передачи, реальная частота клинической инфекции СГБ у новорожденных первых 7 дней жизни составляет 1,3 — 3:1000, родившихся живыми, после 7 дней жизни — 1-1,7: 1000. На каждые 100 инфицированных новорожденных приходится только один случай клинически явной инфекции. Потенциальным источником инфекции является не только мать ребенка, около 16-47% персонала родильного отделения являются носителями СГБ инфекции. Возможна передача инфекции и от новорожденного к новорожденному. Нозокомиальный (больничный) риск инфицирования новорожденных СГБ при отсутствии инфекции у матери составляет 13-43%.
Факторы, предрасполагающие к клиническим формам инфекции (сепсис новорожденных, вызванный СГБ): низкая масса тела, недоношенность (рост заболеваемости в 7-10-15 раз), клинически явный хориоамнионит, внутриматочная инфекция, повышение температуры тела у роженицы, безводный промежуток более 12-18 часов (критический период-24 часа), анамнез инфекции у новорожденного при предыдущих родах. Интактные плодные оболочки, родоразрешение кесаревым сечением не исключают инфицирования новорожденных.
Около 2 / 3 антител к СГБ (класс Ig G) поступает к плоду от матери после 30 недель беременности, причём до 34 недель этот переход существенно меньше, чем в более поздние сроки. Среди новорожденных с сепсисом вследствие СГБ раннее начало заболевания (первые 7 дней жизни) встречается в 80,7%, а позднее- в 19,3%. При обоих вариантах сепсиса смертность примерно одинакова: 5,7 — 6%.
Клинические проявления. Сепсис с ранним началом чаще возникает в первые 48 часов после рождения: у 60% — первые сутки (до 56% симптоматика проявляется при рождении), в основном у недоношенных и маловесных детей от матерей с факторами риска. Заболевание характеризуется бактериемией с клиническими проявлениями сепсиса: менингитом (30%) и пневмонией (40%). Возможна молниеносная форма заболевания с клиникой септического шока, респираторным дистрессом и летальным исходом через несколько часов.
Сепсис с поздним началом (1 неделя-12 недель) проявляется менингитом (85%), в 20-30% случаев ему предшествуют симптомы со стороны верхних дыхательных путей, возможны местные проявления инфекции: отит, синусит, конъюнктивит, артрит, поражения кожи.
СГБ являются частой причиной послеродовых инфекционных заболеваний у матери: послеродовый эндометрит. Типичным является резкое повышение температуры тела в первые 12 часов после родов с тахикардией, ознобом, болезненностью матки и области параметрия. Возможны проявления инфекции со стороны мочевыводящих путей.
Диагностика. «Золотым» стандартом в диагностике бессимптомной колонизации СГБ мочеполовых путей и желудочно-кишечного тракта беременных является культуральный метод с использованием селективных сред, где антибиотики подавляют рост нормальной флоры половых путей и грам-отрицательную кишечную флору.
Большинство инфицированных новорожденных (99%) не имеют симптомов заболевания, поэтому факт колонизации СГБ следует устанавливать культуральным методом. Места для взятия проб: пупок, горло, наружный слуховой проход, прямая кишка. Возможно определение грам- положительных кокков в АЖ, аспирате желудка и трахеи. Высокой точностью диагностики обладает определение специфической ДНК: Ч(чувствительность), Сп(специфичность) и Пц(прогностическая ценность: положительная и отрицательная) по отношению к культуральному методу составляют, соответственно-71, 90, 61, 94%.
Лечение. При известном возбудителе средством выбора является пенициллин. Но, так как лечение чаще проводится эмпирически, при наличии смешанной флоры рекомендуется применять антибиотики с более широким спектром действия: ампициллин, полусинтетические пенициллины (мезло-, пипера-, тикарциллин), цефалоспорины 1-го и 2-го поколения, а также эритромицин, клиндамицин. Отмечается резистентность СГБ к тетрациклину и аминогликозидам, но при одновременном введении пенициллина они усиливают его действие (синергизм).
Профилактика. Её важность обусловлена тяжестью заболевания и его исходами у новорожденных, а также основным звеном патогенеза стрептококковой инфекции у новорожденных: её вертикальной передачей. Дородовое введение антибиотиков у беременных неэффективно и не должно применяться, т. к. при половой жизни наступает реколонизация, а инфекция, кроме того, сохраняется в прямой кишке, где кишечная флора, продуцирующая бета-лактамазы, разрушает пеницллин. Последние 10 лет рекомендуется введение антибиотиков в родах: ампициллин 1-2,0 в/в с повторным введением 1,0 через 4-6 часов.
Американское общество АГ (1993-1994г.) предлагает проводить профилактику инфекции СГБ в родах всем роженицам с факторами риска (10-35% всех беременных, или около 20%). При этом профилактику не получат 20-30% беременных, колонизированных СГБ, но не имеющих факторов риска. Американская академия педиатрии (1992г.) предлагает проводить скрининг беременных в 26 недель культуральным методом, а антибиотики в родах вводить только колонизированным женщинам с факторами риска (4-6% всех беременных). При этом профилактику не получат 4-8% инфицированных беременных, которые колонизированы СГБ после 26 недель.
> Следует отметить, что местное применение бактерицидных средств (хлоргексидин в виде орошения влагалища через 6 часов) — неэффективно. Профилактическое введение антибиотиков новорожденным в первые 90 минут жизни (бактериемия, смертность) — неэффективно. Польза такого введения отмечена при наличии клиники СГБ инфекции у одного ребенка из двойни, а также при анамнезе стрептококковой инфекции новорожденного при предыдущих родах.
МИКОПЛАЗМЫ
Группа микроорганизмов населяющая, как правило, слизистые дыхательных и половых путей. Различают несколько различных по антигенным свойствам видов, вызывающих инфекцию у человека: Mycoplasma pneumoniae, являющаяся причиной атипичных пневмоний, и генитальные микоплазмы: M. fermentans, M. primatum, M. hominis, недавно описанная и связываемая с воспалительными процессами малого таза M. genitalium, Ureaplasma urealyticum. M. hominis и U. urealyticum, наиболее часто встречающиеся в половых путях микроорганизмы, в последние 20 лет рассматривались как предполагаемая причина разнообразных заболеваний: самопроизвольные аборты, маловесные дети, мертворождения, послеродовые инфекции, хорионамниониты, бесплодие, воспалительные заболевания малого таза. Однако, данные исследований последних лет свидетельствуют о более скромной роли этих вездесущих организмов в патогенезе заболеваний половых путей.
Филогенетически М. находятся между бактериями и вирусами. М. являются мельчайшими из известных свободно живущих организмов, отличных от бактерий отсутствием клеточной стенки, а от вирусов- содержанием ДНК и ростом в среде без клеток. М. hominis отличается от Ur. urealyticum морфологией колоний, метаболизмом и чувствительностью к антибиотикам. Микоплазма- аеробный микроорганизм, превращающий аргинин в орнитин с освобождением аммиака. Уреаплазма- микроаэрофильный организм, превращающий мочевину (субстрат необходимый для роста) в аммиак.
Эпидемиология. Новорожденные колонизируются генитальными микоплазмами во время рождения. Колонизация влагалища уреаплазмой отмечается у 1/3 — 1/2 новорожденных девочек (24%- носоглотки, 9%- прямой кишки). Колонизация микоплазмой встречается несколько реже. Клинических проявлений у новорожденных колонизация не вызывает. Метод родоразрешения на частоту колонизации не влияет. При безводном промежутке менее 1 часа частота колонизации снижается (до 22%). В течение первого года жизни процент колонизации прогрессивно снижается, и препубертатном периоде встречается редко. После периода полового созревания колонизация нарастает вместе с частотой половых контактов. У здоровых сексуально активных женщин уреаплазма выделяется в 40-95%, а микоплазма- в 15-72%. У беременных и небеременных женщин микоплазмы выделяются с одинаковой частотой. Степень колонизации связана с половой активностью (количество партнеров), возрастом женщины (снижение после 30 лет), уровнем образования и доходов семьи, с семейным положением.
Диагноз инфекции основан на выделении организма из очага и демонстрации повышения титра специфических антител. В чистой культуре микроорганизм высевается крайне редко. Основной средой для выявления организма является мясной бульон (говяжье сердце) с добавлением свежего грибного экстракта, конской сыворотки и антибиотиков, подавляющих рост бактерий. Немногие лаборатории имеют возможность культивировать микоплазмы. Но это не имеет практического значения, т. к. клинические ситуации, требующие этого исследования, крайне редки.
Серологические тесты для выявления серологического ответа на присутствие микоплазм включают: агглютинацию, фиксацию комплемента, непрямую гемагглютинацию, тест подавления метаболизма, ELISA. В тесте подавления метаболизма специфический метаболит (аргинин для M. hominis или мочевина для уреаплазм) вводится в среду, содержащую фенол красный, антитела и микроорганизмы. Антитела ингибируя размножение микроорганизмов, препятствуют изменению цвета индикаторов рН среды. Метод ELISA устанавливает наличие специфических антител классов G, M, A. Если тесты, основанные на поиске антител к M. hominis считаются достаточно надежными, то серологические тесты в отношении уреаплазм менее точны. Значительный подъём титра антител доказывает факт недавно бывшей инфекции, но не указывает на её место.
Клинические проявления.
1. Этиологическая связь микоплазм с самопроизвольными абортами не была доказана.
2. Не обнаружено связи микоплазм с хромосомными аномалиями или врожденными уродствами плода.
3. Связь наличия микоплазм в половых путях с повторными абортами признана случайной и неубедительной.
4. При гистологических признаках хориоамнионита и при инфекции околоплодных вод роль уреаплазмы не доказана: высеваемость из крови и амниотической жидкости не отличалась от контроля. Роль M. hominis более очевидна: при инфекции околоплодных вод она редко высевается из крови (2-5%), несколько чаще из АЖ (до 35% против 8% контроля), и в 85% отмечается значительный рост титра антител. Однако, изоляция M. hominis из АЖ более, чем в 80% случаев сочетается с наличием там высоковирулентных бактерий (возможная причина инфекции АЖ).
5. Генитальные микоплазмы, заселяющие организм плода во время родов, не рассматриваются, как причина серьёзных инфекций у новорожденного. М. отсутствуют в крови и спиномозговой жидкости при сепсисе новорожденного, в моче встречаются редко (9-10%). Чаще высеваются в дыхательных путях у глубоко недоношенных (менее 1500,0) новорожденных.
6. Колонизации уреаплазмой влагалища беременных в 23-26 недель не связана с низкой массой новорожденных, преждевременным излитием вод и преждевременными родами. Прием эритромицина, препарата избирательно действующего на уреаплазму, не влиял на исходы беременности, а частота выделения уреаплазм из половых путей не изменялась (84%-79%). При преждевременных родах из АЖ уреаплазма выделена в 2,2%, а микоплазма — в 1,5% (по другим данным-11% и 7%). Но, если из АЖ выделяются только микоплазмы, то при сравнении с женщинами со стерильными водами нет различий в ответе на токолиз и во времени до родоразрешения.
7. Послеродовая инфекция. Генитальные микоплазмы часто высеваются из крови родильниц с лихорадкой (12,8%), M. hominis и уреаплазма высеваются с одинаковой частотой. Выделение микоплазм сопровождается подъёмом титра специфических антител. В то же время подъём температуры невысок, длится всего 1-2 дня, клинические проявления минимальны и бесследно проходят даже без применения специфической антибиотикотерапии. Истинная частота эндометритов, вызванных M. hominis, неизвестна, а роль микоплазм в развитии послеродовой инфекции, особенно в сравнении с другими микроорганизмами, неясна.
8. Воспалительные заболевания малого таза. Основываясь на микробиологических и серологических исследованиях предположительную роль M. hominis в ВЗМТ можно отметить в 10-30% случаев. Так как установлена тесная связь M. hominis и бактериального вагиноза (БВ), то выделение микоплазм из половых путей женщин с ВЗМТ, возможно, указывает на роль в этом заболевании микроорганизмов, вызывающих БВ. Уреаплазма не играет никакой роли в этиологии ВЗМТ.
9. Бесплодие. У лиц с бесплодием и без него уреаплазмы выделяются с одинаковой частотой. При исследовании случаев необъяснимого бесплодия не выявлено связи между наличием микоплазм и числом, подвижностью сперматозоидов (посткоитальный тест), качеством шеечной слизи, частотой последующей беременности. Безуспешное лечение бесплодных пар тетрациклином подтверждает отсутствие заметной роли микоплазм в проблеме бесплодия.
Лечение. Активными в отношении микоплазм являются препараты, подавляющие синтез белка. Тетрациклины одинаково эффективны против как M. hominis, так и уреаплазмы. M. hominis чувствительна к линкомицину, но устойчива к эритромицину. Уреаплазма, наоборот, чувствительна к эритромицину, но устойчива к линкомицину. Клиндамицин имеет высокую активность в отношении M. hominis, и среднюю в отношении уреаплазмы. Некоторую активность в отношении микоплазм имеют аминогликозиды. Следует отметить, что удалить уреаплазму из половых путей очень трудно, т.к. кислая среда влагалища инактивирует такие антибиотики, как эритромицин. Ввиду недоказанности причинной роли микоплазм в заболеваниях половых путей в акушерстве и гинекологии прямые показания для лечения, направленного против микоплазм, возникают крайне редко. При повторных абортах, преждевременных родах, бесплодии неясного генеза лечение в отношении микоплазм рассматривается, как клинический эксперимент. В ситуациях, где M. hominis, возможно, является причиной заболевания: эндометриты и послеродовая лихорадка, инфекция околоплодных вод, хороший клинический эффект обычно достигается при использовании антибиотиков, не оказывающих воздействия на микоплазмы.
ХЛАМИДИИ.
Chlamydia trachomatis — наиболее распространенный из микроорганизмов, передающихся половым путём. С начала 1980-х значительно возросло внимание к хламидиям, как причине воспалительных заболеваний половых путей, к последствиям этих заболеваний для репродуктивной функции и для здоровья новорожденного (атипичные формы ВЗМТ, конъюнктивиты новорожденных, пневмонии).
Род хламидий составляют три вида. C. psittaci вызывает пситтакоз- заболевание птиц и низших млекопитающих, у человека встречается редко. C. pneumoniae вызывает острые воспалительные заболевания дыхательных путей у человека. C. trachomatis имеет 15 серотипов. Три из них (L1, L2, L3) вызывают венерическую лимфогранулёму (ВЛГ), серотипы А, В, Ва и С являются причиной трахомы, остальные серотипы вызывают воспалительные заболевания половых путей и перинатальные инфекции.
От всех других микроорганизмов хламидии отличаются совершенно особым жизненным циклом, который начинается с инфицирования чувствительных клеток хозяина посредством специфичного для хламидий процесса фагоцитоза. Первая ступень инфекционного процесса- прикрепление метаболически неактивного, но инфекционного элементарного тельца (ЭТ) к клетке хозяина. Обычно это нереснитчатый цилиндрический или кубический эпителий (конъюнктива, уретра, эндоцервикс, эндометрий, маточные трубы). После прикрепления следует фагоцитоз ЭТ им же и индуцируемый. Внутри клетки ЭТ существует в цитоплазматической вакуоли — фагосоме, где хламидии остаются весь цикл роста, а поверхностные антигены микроба ингибируют распад и лизис фагосомы. Возможно, это одна из причин хронизации инфекции. Далее ЭТ преобразуется в сетчатое тельце (СТ), уже метаболически активное и способное к делению. СТ неинфекционно и не может выжить вне клетки. СТ делятся 8-24 часа, конденсируются и превращаются в новые ЭТ. Через 48-72 часа клетка разрушается и ЭТ выделяются во внешнюю среду. Этим начинается новый цикл размножения хламидии, который длится около 48 часов.
Хламидия напоминает вирус тем, что является полностью внутриклеточной бактерией: зависит от питательных веществ и энергии клетки-хозяина, не синтезирует АТФ, являясь энергетическим паразитом. Но, как и все бактерии, содержит ДНК и РНК, размножается делением, имеет твердую оболочку наподобие грамотрицательных бактерий, которая содержит сходный липополисахарид.
Эпидемиология. Путь передачи инфекции в основном половой. Передача более трудна, чем у гонококка. Подсчитано, что риск заражения женщины от инфицированного партнёра составляет около 40-45% при хламидийной, и около 80% при гонококковой инфекции. В 1/2-1/3 случаев хламидии являются причиной негонококкового уретрита у мужчин, и примерно в половине случаев- синдрома Рейтера. Весьма часта смешанная, хламидийно-гонококковая инфекция: при наличии гонореи хламидии обнаружены у 30-50% женщин и 20-40% мужчин. В женских половых путях наиболее часто поражается шейка матки (эндоцервикс). Заболевание не имеет специфических симптомов, многие случаи клинически не проявляются. Слизисто-гнойный цервицит (является аналогом негонококкового уретрита у мужчин) повышает риск ОВЗМТ, является резервуаром половой передачи и неонатальной инфекции.
Многие сексуально активные женщины в течение жизни имели эпизоды хламидийной инфекции. Антитела к хламидиям обнаружены у 20-40% женского населения. Большинство из этих женщин на момент обследования инфекции не имеют. Частота сероконверсии нарастает к 30 годам, далее роста не наблюдается. Из шейки матки хламидии выделяются у 3-5% женщин. Важен характер обследуемого контингента: хламидии выделяются в 15-33% у пациентов клиник венерических болезней, в 29-68% у партнёров мужчин с негонококковым уретритом, в 67-74% при доказанном хламидийном уретрите партнёра, в 28-63% у женщин со слизисто-гнойным цервицитом.
Факторы риска хламидийной инфекции: эндоцервикоз, молодой возраст, низкий социально-экономический статус, количество половых партнёров, прием ОК (с высоким содержанием эстрогена-50мкг). Любые ИППП повышают риск хламидиоза. У беременных факторами риска являются: беременность вне брака, возраст менее 20 лет, другие ИППП, поздняя явка, уретрит у полового партнёра, слизисто-гнойный цервицит, пиурия при отсутствии бактерий в моче.
Клинические проявления. Инфекционные заболевания половых путей женщин, вызванные хламидиями, напоминают проявления гонореи. Но хламидийная инфекция в 5 раз чаще бывает бессимптомной, инфицированные лица сохраняют микроорганизм длительное время, инкубационный период при заражении C. trachomatis (6-14 дней) значительно дольше, чем при заражении N. gonorrhoeae. Поэтому среди населения существует большой резервуар инфекции, повышающий риск восходящей инфекции, угрожающей репродуктивному здоровью женщин.
Эндоцервицит. Шейка матки-часть половых органов, наиболее часто поражаемая хламидиями, которые являются специфическими паразитами цилиндрического (кубического) эпителия, поражая переходную зону и эндоцервикс. Эктоцервициты и вагиниты не связаны с хламидийной инфекцией.
Две трети женщин с хламидийной инфекцией шейки не имеют симптомов заболевания. Пораженная шейка может выглядеть нормальной или отёчной, с гипертрофической эрозией и гнойно-слизистыми выделениями из канала. Часто наблюдается картина «фолликулярного» цервицита. Признаком хламидийного цервицита является наличие при иммерсионной микроскопии 10 и более полиморфоядерных лейкоцитов в поле зрения в мазке шеечной слизи, окрашенной по Граму. Дисплазия эпителия шейки матки чаще встречается у лиц с хламидийной инфекцией.
Острый уретральный синдром характеризуется дизурией, частым мочеиспусканием, пиурией при отсутствии бактериурии (число микроорганизмов менее 100 тыс./мл). Предполагают, что в 25-50% случаев причиной синдрома может быть C. trachomatis. Это наиболее вероятно у женщин, принимающих ОК, при симптомах инфекции у полового партнёра и длительном существовании симптомов заболевания (до 14 дней) и отсутствии анамнеза повторных инфекций мочевыводящих путей. У женщин с острым циститом или бактериурией симптомы длятся около 4 дней и имеется анамнез инфекций мочевыводящих путей. У лиц с указанным синдромом антибактериальная терапия неэффективна.
Эндометрит. У 50% пациентов со слизисто-гнойным цервицитом имеются гистологические признаки эндометрита: плазматические клетки и инфильтрация ПМЯ лейкоцитами, что сопровождается обнаружением C. trachomatis культуральным и гистоиммунологическим методами. У всех пациентов с хламидийным сальпингитом обнаружены гистологические признаки эндометрита. Субклинический, персистирующий хламидийный эндометрит может сохранятся у пациентов, получавших антибактериальную терапию по поводу ОВЗМТ, являясь важным резервуаром хламидийной инфекции, промежуточной ступенью её распространения из шейки и влагалища в маточные трубы. Сопутствующий эндометрит, вероятно, является причиной маточных кровотечений, часто сопровождающих ОВЗМТ.
Острый сальпингит является самым серьёзным осложнением хламидиальной инфекции. При исследовании эпителия шейки матки и маточных труб, при проведении серологических проб связь сальпингита с C. trachomatis выявлена 30-50-67%. В настоящее время считается, что не менее чем у 20-40% пациентов с ОВЗМТ их причиной является хламидийная инфекция. По некоторым данным клинически явные случаи хламидийной инфекции составляют менее 50%, в остальных случаях заболевание протекает атипично, при отсутствии анамнеза, но с морфологическими изменениями, регистрируемыми при лапароскопии (гидросальпинкс).
Синдром Фитц-Хью-Куртиса (1930-1934гг.) — острый перигепатит, приводящий к массивному спаечному процессу между передней поверхностью печени и брюшиной диафрагмы, что вызывает боли в правом верхнем квадранте живота, часто принимаемые за признаки острого холецистита. Синдром считается следствием острого сальпингита гонорейной этиологии. В последние годы опыты на приматах и серологические исследования доказывают этиологическую связь синдрома с хламидийной инфекцией.
Беременность и новорожденные. C. trachomatis выделяется из шейки матки у 5% беременных (2-37%). У 60-70% новорожденных, рожденных этими женщинами, имеются серологические признаки хламидийной инфекции. Примерно у 30% (20-50%) новорожденных в первые 2 недели развивается конъюнктивит, а у 10-20% новорожденных в пределах 3-4 месяцев жизни- пневмония. Кесарево сечение, произведённое при целых плодных оболочках, может предотвратить заражение новорожденного хламидиями. Размеры проблемы инфицирования новорожденных определяются распространённостью хламидийной инфекции в шейке матки.
Конъюнктивит новорожденных, вызываемый хламидиями, был впервые описан в 1910 офтальмологами, которые высказали предположение о наличии специфического инфекционного агента в половых путях матери. Заболевание начинается в первые 5-14 дней после родов, наиболее часто- в первый месяц жизни. В большинстве случаев заболевание даже без лечения разрешается самостоятельно, в первые месяцы жизни. При длительном течении возможно образование паннуса, рубцов конъюнктивы. При раннем лечении К., как правило, заканчивается без последствий. Диагностика основана на окрашивании соскоба конъюнктивы по Гимзе (типичные инклюзионные тельца), культуральном методе, определении антигена хламидий (моноклональные флюоресцирующие антитела, ELISA). Серологическая диагностика не используется ввиду наличия у новорожденного антител к хламидиям, полученных от матери.
Профилактика гонобленореи нитратом серебра и сульфацилом натрия неэффективна в предупреждении хламидийной инфекции. Методом профилактики как гонорейной, так и хламидийной инфекции является применение глазных мазей, содержащих эритромицин или тетрациклин. Другим направлением профилактики заболеваний новорожденных является выявление и лечение беременных, инфицированных хламидиями.
Пневмония. До 1975 г. роль хламидий в этиологии пневмоний новорожденных не признавалась. Почти все случаи регистрируются в первые 8 недель жизни, при этом наличие предыдущего конъюнктивита не является обязательным (встречается в 50%). Заболевание начинается с симптомов со стороны верхних дыхательных путей, часто без повышения температуры тела. Отмечается заложенность носа (без выделений), в половине случаев — выбухание барабанной перепонки. Симптомы со стороны нижних дыхательных путей проявляются в виде тахипноэ, кашля типа «стаккато», возможны приступы апноэ. Характерны крепитирующие хрипы на вдохе, хрипы на выдохе- редкость. На рентгенограмме лёгких регистрируется их расширение (вздутие) и двусторонние симметричные интерстициальные инфильтраты. В анализе крови: количество лейкоцитов в норме, количество эозинофилов-повышено. КОС крови у многих детей указывает на умеренную гипоксию. В плазме крови повышены титры специфических Ig G и Ig M.
Диагноз подтверждается высоким титром Ig M (более 1:32), а также культуральным методом, который является основным. Методы, направленные на определение антигена хламидий, обладают низкой чувствительностью и специфичностью. Лечение: эритромицин per os в дозе 50 мг/кг/сутки, разделённой на 4 приёма, в течение 10-14 дней. Эффективность лечения составляет 80%, возможно проведение повторного курса. Хламидийная инфекция у беременных. Значительное количество исследований, проведённых в 1980-1990 гг., не подтвердили связь хламидийной инфекции эндоцервикса и послеродовых заболеваний. Эндометрит после аборта развивается у 10-35% женщин с хламидийным цервицитом. Учитывая эти данные, следует рассмотреть целесообразность обследования на наличие хламидий в шейке матки женщин, планирующих прерывание беременности, с последующей профилактикой ОВЗМТ тетрациклином во время операции аборта.
Выкидыши и мертворождения: несмотря на отдельные сообщения, большинство исследований отрицают связь этих осложнений беременности с хламидийной инфекцией.
Недонашивание, низкая масса при рождении, преждевременное излитие вод. Сведения о связи этих осложнений беременности с хламидийной инфекцией у беременных противоречивы: несмотря на отдельные сообщения, большинство исследователей в разных странах мира эту связь не подтверждают.
Диагностика. Кроме клинической картины заболевания возможно исследование соскоба клеточного материала эндоцервикса и уретры (слизь и гной необходимо удалить тампоном): окрашивание по Граму с подсчётом полиморфонуклеаров под большим увеличением (более 30 в поле зрения).
Цитологический метод основанный на выявлении специфических внутриклеточных «включений» в клеточном материале соскобов с эпителиальных покровов, окрашенных по Папаниколау, применяется редко, т.к. очень неточен (чувствительность 20%). Его можно рекомендовать только для диагностики инклюзионных конъюнктивитов у новорожденных.
Данные серологического исследования по существу бесполезны: ввиду наличия антител к хламидиям у сексуально активного населения (до 40%) диагностика неконкретна, а положительные данные одного исследования свидетельствуют лишь о перенесенной в прошлом инфекции. Случай «свежей» инфекции подтверждают титры Ig M, или подъём специфического Ig G в 4 раза. Титры специфических антител не дают возможности судить о клинической форме, локализации или течении инфекции. В то же время, отсутствие антител к хламидиям исключает наличие инфекции, а серологические тесты могут применяться как метод скрининга в группах населения с низкой частотой хламидийной инфекции. При положительных тестах необходимо подтверждение наличия инфицирования выявлением специфического антигена, культуральным методом. Возможно и эмпирическое лечение, что, однако, не рекомендуется ввиду широкого распространения C. pneumoniae, серологически не отличимой от C. trachomatis.
Культуральный метод является стандартом. При необходимости транспортировки применяется специальная среда (сукрозосульфат), содержащая антибиотики: гентамицин, ванкомицин, нистатин. Среда с пробой сохраняется охлаждённой (на льду), инокуляцию в среду культивирования следует провести в пределах суток, иначе пробу следует заморозить при 70 С0. Культура клеток (МакКоя) с пробой выдерживается 24-72 часа, затем проводится окрашивание (йодом, по Гимзе, мечеными флуоресцином моноклональные антитела) и микроскопия. Чувствительность метода достигает 70-80%, при повторном пассаже через среду культивирования можно выявить ещё 10-20% случаев инфицирования.
Обнаружение специфического антигена является более быстрым и дешёвым методом диагностики хламидиоза. В настоящее время существуют два доступных метода определения антигена хламидий. Во-первых, прямое окрашивание флуоресцирующими моноклональными антителами элементарных телец в мазках с чувствительностью более 90% и специфичностью около 95% (в сравнении с методом культуры). Во-вторых, метод ELISA с чувствительностью и специфичностью соответственно 90% и 90%. Ложно- положительные результаты обоих методов составляют 2-3%. При обследовании групп населения с низкой частотой хламидийной инфекции (2-3%) положительная прогностическая ценность метода (совпадение результата теста с наличием заболевания), несмотря на высокую Ч. и Сп., составляет около 50%. Иными словами, положительный результат теста оказывается правильным лишь в половине случаев.
Полимеразная цепная реакция (ПЦР) позволяет увеличивать число специфических участков ДНК в 100 000 и более раз, делая их доступными для идентификации. Метод является лучшим по точности для диагностики хламидиоза среди групп населения с низким уровнем инфицирования, а его Ч., Сп., Пц приближаются к 100%.
Обследование на наличие инфицирования хламидиями показано всем женщинам, живущим половой жизнью, что, к сожалению, пока недостижимо. Реально в обследовании на хламидиоз половых путей нуждаются женщины с высокой вероятностью инфекции: слизисто-гнойный цервицит, эндометрит, ОВЗМТ, уретрит (или уретрит у полового партнёра). При обследовании групп населения с низкой частотой инфицирования следует использовать культуральный метод или ПЦР. При высокой частоте инфицирования (более 8%) возможно применение методов прямого окрашивания флуоресцирующими антителами или ELISA.
Лечение. Первым шагом профилактики заболевания является осуществление программы скрининга на инфицированность хламидией половых путей женщин, которая является очагом для вертикальной и горизонтальной передачи инфекции, существенно повышает риск нарушения процессов репродукции и заболеваний новорожденного, причём, в первую очередь внимания заслуживают беременные.
Существуют три основных направления в борьбе с инфекцией: 1. Меры, направленные на уменьшение резервуара инфекции: а) широкое использование тетрациклина в лечении гонореи устранит существующую одновременно хламидийную инфекцию, б) Лечение в случае негонококкового уретрита обоих партнёров тетрациклином или эритромицином, в) такой же подход к лечению слизисто-гнойного цервицита.
2. Предупреждение перинатальной инфекции: замена нитрата серебра и сульфацила натрия, применяемыми для профилактики гонобленореи на глазные мази, содержащие эритромицин или тетрациклин, активные в отношении хламидий.
> Следует отметить, что данный подход не устраняет опасности респираторной инфекции у новорожденных, и значительно уступает по эффективности мерам, направленным на устранение инфекции в половых путях женщин.
3. Предупреждение контакта новорожденного с инфекцией в процессе родов: выявление и лечение беременных с инфицированным эндоцервиксом. Обследование всех беременных дорогостоящее мероприятие и при частоте инфицирования в популяции менее 5% более выгодно с (экономической точки зрения) обследование и лечение новорожденных. При частоте инфекции более 6% становится экономически выгодным обследование и лечение беременных. Лечение беременных в 37 недель эритромицином в течение 1 недели снижает уровень инфицирования новорожденного с 50% до 7%. Лечение амоксициллином устраняет инфекцию у 98% беременных, а 95% новорожденных остаются здоровыми. Возможно применение клиндамицина с уровнем эффективности 92,7%.
Рекомендуемый режим лечения вне беременности * Доксициклин per os 100 мг 2 раза в сутки в течение 7 дней (контроля излеченности не требуется) * Азитромицин (суммамед) per os одна доза 1, 0 грамм (контроля излеченности не требуется)
Другие режимы: * Офлоксацин per os 300 мг 2 раза в сутки в течение 7 дней (контроль излеченности через 3 недели). * Ципрофлоксацин неэффективен. * Эритромицин per os 500 мг 4 раза в сутки в течение 7 дней (контроль излеченности через 3 недели) * Ампициллин per os 2,0 в сутки в течение 10 дней (контроль излеченности).
Возможно применение рифампицина или клиндамицина, применение последнего особенно важно при лечении ОВЗМТ в дозе 600 мг 4 раза в сутки внутримышечно.
Рекомендуемый режим лечения при беременности * Эритромицин (основание) per os 500 мг 4 раза в сутки в течение недели или в дозе 250 мг 4 раза в сутки в течение 14 дней. * Амоксициллин per os 500 мг 3 раза в сутки в течение 7-10 дней
Лечение новорожденных. Лечение конъюнктивита новорожденных растворами тетрациклина или эритромицина в каплях признано недостаточно надёжным. Поэтому любые проявления хламидийной инфекции у новорожденных являются показаниями для системной терапии эритромицином, устраняющей носоглоточную колонизацию и предупреждающей развитие пневмонии. Эритромицин назначается в дозе 40 мг / кг / сут в течение 2 недель.
ГЕРПЕС.
Возбудитель-herpes simplex virus, относится к семейству вирусов герпеса, куда также входят вирусы цитомегалии, ветряной оспы и другие. Заболевание передаётся половым путём и вызывается двумя типами вируса: 1 и 2. Вирус содержит ДНК, окружённую оболочкой из гликопротеинов. Область гениталий в основном поражается ВПГ-2, но в 15% случаев встречается ВПГ-1 (до 20-40% при орогенитальном контакте). Антитела к обоим типам вируса имеют перекрёстную реактивность и большинством лабораторий не разделяются.
Различают первичное заражение и возвратную форму заболевания (рецидив). Вирус проникает в нервное окончание, далее, через аксон нервной клетки, — в ганглии (чувствительные и вегетативные) заднего корешка спинного мозга, где существует пожизненно. Пациенты, имеющие антитела к ВПГ-1 могут инфицироваться ВПГ-2. В этом случае инфекция протекает короче, чем при первичном инфицировании ВПГ-2, поэтому выделяют впервые возникший непервичный генитальный герпес.
Герпетическая инфекция чаще проявляется в виде рецидивов, а их частота в 3-4 раза выше при инфицировании ВПГ-2. При этом 25% всех рецидивов инфекции протекают в виде клинически бессимптомного выделения вируса. Примерно 5% населения имеет анамнез генитальной герпетической инфекции, ещё 15-30% имеют специфические антитела к ВПГ-2 без анамнеза. У беременных антитела к ВПГ-2 встречаются в 16-29%. ВПГ-2 можно выделить из шейки матки в 80-86% при первичной инфекции, в 65% при впервые возникшем непервичном герпесе, и только в 12% при возвратной форме заболевания. Следует отметить, что роль ВПГ в этиологии рака шейки матки отвергнута, а причинным фактором считается вирус папилломы человека.
Клинические проявления инфекции. Выделяют три различных синдрома:
1. Первый эпизод первичного генитального герпеса развивается у лиц, не имеющих антител к ВПГ. При активном выделении вируса заражаются около 75% партнёров. Характерны выраженные местные симптомы с множественными болезненными поражениями, прогрессирующими до изъязвлений, а также паховая аденопатия, общие проявления: лихорадка, недомогание, миалгия, головная боль, тошнота. У лиц с нормальной иммунной системой болезнь проходит самостоятельно и без последствий, но примерно у 4% первый эпизод герпеса сопровождается менингитом.
2. Первый эпизод непервичного герпеса, который встречается у лиц с антителами к другому, гетерологичному типу вируса. Заболевание протекает мягче, напоминая возвратную форму, но течение его весьма вариабельно. Поэтому в настоящее время признаётся, что достаточно надёжно различать указанные формы можно лишь по наличию антител в сыворотке крови в острый период заболевания.
3. Возвратный герпес (чаще встречается при инфицировании ВПГ-2). Появление типичных поражений предваряется местными продромальными симптомами: боль, зуд, парестезии. Продром продолжается 2 дня. Далее проявляется «мягкая» местная симптоматика, длительность которой составляет 1/2 от обычной длительности эпизода первичного герпеса. Число поражений небольшое, а общие симптомы отсутствуют. Период выделения вируса короче, обычно 3-5 дней, а вероятность его выделения из шейки матки также меньше.
Диагностика. Лучший метод диагностики ВПГ- выделение вируса в культуре, что требует 48-72 часа. Первая попытка выделения вируса даёт 5-30% ложно — отрицательных результатов. Положительный результат теста более вероятен при первичном заражении и менее-при рецидиве заболевания, а также в первые несколько суток от момента заражения (до 72 часов) в сравнении с более поздними посевами. Свежие высыпания чаще дают положительный результат при культивировании вируса в сравнении с подсохшими и изъязвлёнными. Однако, при использовании только клинических признаков и культурального метода диагностики многие случаи заболевания остаются нераспознанными. Значительное число лиц, с доказанным серологически наличием инфекции, не имеют симптомов заболевания или эти симптомы нетипичны: трещины, фурункулы, экскориации, эритема.
Использование специфических моноклональных антител даёт Ч, Сп и Пц соответственно 78%, 98%, 93% и 92%. Совпадение с результатами культуры составляет 75%, но очень важно достаточное количество клеток в мазке: не менее 20. В то же время этот тест не заменяет и не отменяет культуральный метод, так как при низкой частоте заболевания в группе населения диагностическая ценность теста снижается, метод культуры лучше коррелирует с инфекционной активностью вируса, а при бессимптомном выделении вируса из шейки матки чувствительность теста с использованием моноклональных антител вдвое ниже, чем культурального метода.
Ферментный анализ с иммуносорбцией (ELISA). При малой распространённости вируса в группе населения (менее 10%) и при бессимптомном его выделении диагностические результаты метода невысоки, но при клинически явном герпесе они значительно лучше: Ч, Сп и Пц составляют, соответственно, 84-97%, 99%, 89%. В то же время различные системы дают различные результаты, и при данной методике определяется лишь антиген, но не активный вирус.
Полимеразная цепная реакция. По предварительным данным точность диагностики заболевания герпесом приближается к абсолютной (100%).
Серологические тесты не имеют практического значения, так как не могут подтвердить наличие активной инфекции. Они могут быть полезными лишь при неясном анамнезе в отношении заболевания герпесом. Отсутствие антител отрицает заболевание в прошлом, но 80 — 90% всех взрослых имеют антитела к одному или обоим типам вируса.
Для новорожденного при подозрении на инфицирование ВПГ единственным надёжным тестом является метод культуры.
Лечение. В начале 1980-х появилось первое эффективное средство для лечения герпеса — ацикловир (зовиракс). Препарат, накапливается в пораженных вирусом клетках, избирательно взаимодействует с вирусной тимидинкиназой, фосфорилирующей препарат из монофосфата в его активное производное ацикловир трифосфат, который, являясь конкурентным ингибитором вирусной ДНК-полимеразы, останавливает синтез вирусной ДНК. Таким образом обеспечивается избирательность (не накапливается в здоровых клетках) и безопасность действия препарата. Ацикловир существует в форме 5% мази, капсул и суспензии для перорального применения, порошка для приготовления раствора вводимого в/в.
Следует помнить, * что при нанесении мази желательно защищать кожу рук перчатками, * мазь бесполезна при лечении рецидива заболевания и его профилактики, * не должна наносится на слизистую влагалища, так как её основа- полиэтиленгликоль, оказывает раздражающее действие.
Внутривенное введение А. рекомендуется при тяжёлых случаях первичного эпизода заболевания, что сокращает время до выздоровления, смягчает симптомы заболевания и укорачивает время выделения вируса. Доза: 5 мг/кг через 8 часов в течение 5 дней.
В виде капсул препарат вводится при:
1) первичном генитальном герпесе в дозе 200 мг 5 раз в сутки в течение 10 дней,
2) при тяжелых проявлениях возвратной формы заболевания в той же дозе в течение 5 дней (желательно начать лечение при первых признаках заболевания)
3) профилактике частых и тяжёлых рецидивов (около 6 раз в год) в дозе 400 мг дважды в сутки непрерывно до 6 лет (более длительная профилактика не проводилась). Возможны варианты дозирования: от 200 мг дважды в сутки до 200 мг 5 раз в сутки. Показатели иммунитета пациента на фоне лечения не меняются. При прекращении приёма препарата у 86% больных следует рецидив заболевания.
> Следует помнить, что даже при успешном предупреждении клинических форм заболевания, на фоне лечения возможно бессимптомное выделение и половая передача вируса.
Вакцины для предупреждения заболевания пока не существует. Однако, многие больные с лёгкими формами рецидива заболевания не требуют специфического лечения, а только симптоматического.
В настоящее время А. для лечения герпеса незаменим, несмотря на появление новых препаратов. Валацикловир (валтрекс) — L-валиловый эфир А., подвергающийся гидролизу в печени, результатом которого является А. и незаменимая аминокислота L-валин. Препарат имеет более высокую биодоступность в сравнении с А и применяется в лечебной дозе 1000 мг дважды в сутки в течении 10 дней. Профилактическая доза-500 мг раз в сутки. Фамцикловир (фамвир) дольше остаётся в клетках организма (7-20 часов против 1 часа у А.), но менее эффективен в отношении вирусной ДНК-полимеразы. Применяется в лечебной дозе 125-250-500 мг дважды в сутки и по эффективности равен А. Фоскарнет оказывает прямое действие на ДНК- полимеразу. Препарат токсичен и может применяться только местно. Цидовир активируется без участия ВПГ, снижает передачу вируса. Существует в виде геля или 3% крема для местного применения (Триаптен).
Генитальный герпес и беременность.
Эпидемиология. Частота бессимптомной герпетической инфекции половых путей у беременных составляет 0,1-4%. Среди беременных с положительной культурой ВПГ из половых путей частота бессимптомного течения инфекции составляет 13-66%. Беременность не влияет на частоту и тяжесть герпетической инфекции. Возвратная форма заболевания не влияет на исходы беременности (аборты, недонашивание), но влияние первичной формы вполне возможно. Передача вируса плоду через плаценту происходит исключительно редко (единичные случаи), но сопровождается тяжёлыми последствиями: 1/3 новорожденных рождается мёртвыми, все живые-с неврологическими осложнениями.
Герпес новорожденных встречается с частотой 1/5 000-1/20 000 родов. Передача вируса возможна при влагалищных родах, кесаревом сечении в случае преждевременного излития вод, нозокомиально. Наибольший риск передачи ВПГ новорожденному существует при первичной инфекции: 50% (20-80 %), а смертность достигает 50%, при этом не отмечается поражения кожных и слизистых покровов. При возвратной форме заболевания риск инфицирования новорожденного не превышает 4%, составляя реально примерно 1%. Ввиду преобладания бессимптомных форм заболевания около 70% всех случаев герпеса новорожденных, встречается при отсутствии симптомов вирусной инфекции гениталий у матери. Материнские антитела к ВПГ не являются надёжной защитой для новорожденного.
Первичная инфекция у матери в I и во II триместре примерно в 20% случаев приводит к недонашиванию. Первичная инфекция в III триместре имеет самые серьёзные последствия: недонашивание, ЗРП, мертворождение, заболевание новорожденного. Примерно 10-11% беременных продолжают выделять вирус после первого эпизода заболевания. Рецивные формы заболевания и непервичные эпизоды менее опасны (выделение вируса в культуре из половых путей в 0,5%). В то же время следует помнить, что бессимптомный носитель ВПГ может быть источником инфекции для новорожденного. При анамнезе возвратной формы герпеса бессимптомное выделение вируса на момент родоразрешения встречается у 1% (0,75-3%) беременных. Риск заболевания новорожденного в этих случаях составляет менее 1:1000. Не все женщины, у которых выделена культура генитального герпеса имеют анамнез его клинических проявлений. Поэтому, при отсутствии симптомов у матери предсказать и предотвратить контакт новорожденного с ВПГ практически невозможно.
Риск заболеваемости новорожденных при недавно перенесённой матерью инфекции в 10 раз выше, чем при рецидивных формах заболевания у беременных. Как первичный, так и непервичный первый эпизод заболевания приводят к заболеваемости новорожденных в 30-40% случаев. Присутствие ВПГ в шейке матки, как и повреждения кожи головки, повышают риск заболевания новорожденного. Материнские антитела к ВПГ-2, но не к ВПГ-1, оказывают защитное действие на новорожденного. При прогнозировании заболеваемости новорожденных необходимо учитывать внеполовые источники ВПГ: поражение пальцев, губ у больничного персонала и родителей, ухаживающих за ребёнком. Профилактика заболеваемости новорожденных. За последние 30 лет не создано надёжного метода предупреждения герпетической инфекции у новорожденных. Эффективность кесарева сечения при наличии ВПГ в половых путях при безводном промежутке более 4 часов является сомнительной. Амниоцентез перед КС для определения внутриутробного инфицирования в настоящее время проводить не рекомендуется, т.к. риск его осложнений превышает частоту трансплацентарной передачи. Кроме того, нередкой является ситуация, когда при выделении положительной культуры вируса из шейки матки и АЖ, новорожденный после влагалищных родов не имеет ни клинических, ни серологических признаков заболевания. Рекомендовавшаяся до 1988 года тактика ведения, заключавшаяся в еженедельном определении культуры вируса в половых путях для прогноза возможного инфицирования новорожденного в родах, сегодня признана дорогостоящей и неэффективной. Периоды выделения вируса из половых путей составляют 3-5 дней и часто остаются нераспознанными.
Ведение беременности
При анамнезе заболевания генитальным герпесом у беременной (или партнёра): — при отсутствии высыпаний на половых органах проводить роды через влагалище — провести обследование матери и новорожденного методом культуры на момент родов — изоляция матери не требуется — при данном подходе риск неонатальной инфекции очень мал: 1:1000 родов.
При появлении герпетических высыпаний на половых органах в родах или при преждевременном излитии околоплодных вод: — проведение КС снижает риск заболеваемости новорожденного — операцию провести до или в пределах 4 часов от момента излития околоплодных вод — при безводном промежутке более 4 часов проведение КС также является целесообразным — у беременных с возвратными формами заболевания вероятность инфицирования новорожденного очень низка, а польза КС сомнительна: дорого, возможны осложнения для матери.
При появлении высыпаний перед родами: — рекомендуется культуральное исследование или ПЦР с интервалом 3-5 дней. При отсутствии вируса в половых путях вести роды через влагалище. — при первичном эпизоде герпеса, когда рецидивы более часты, а осложнения для новорожденного более вероятны, оправданным подходом является еженедельное определение культуры вируса в половых путях в последние недели беременности.
При влагалищных родах и доказанной герпетической инфекции половых путей: · ознакомить родителей с возможной симптоматикой заболевания — при первичном эпизоде заболевания выделение вируса у новорожденного методом культуры или ПЦР (глаза, глотка, спиномозговая жидкость, стул, моча) является обязательным. Любой положительный тест у новорожденного старше 48 часов, особенно из спиномозговой жидкости, является показанием к в/в введению А.
При проявлениях герпетической инфекции у беременной в сроке менее 30 недель тактика ведения является выжидательной, а родоразрешение КС не рекомендуется.
При герпетических высыпаниях вне половых органов риск появления ВПГ в шейке матки низок: 1-2%, что сравнимо с таковым при возвратных формах заболевания. Рекомендуется вести роды через влагалище, прикрыв поражённые места салфетками. Не забывать о защите рук персонала.
Лечение при беременности возможно при тяжёлых формах заболевания, угрожающих жизни матери. На сегодняшний день проведение лечения А. при беременности для предупреждения рецидивов заболевания не рекомендуется. В то же время, в проведённых исследованиях, где беременные с этой целью получали А., отмечено снижение частоты обнаружения ВПГ в половых путях, и, как следствие, частоты КС. Проявлений токсичности препарата, осложнений беременности, отрицательных последствий для плода не выявлено.
Инструкции матери с клиническими проявлениями герпеса: — избегать контакта с очагом поражения (ношение белья, мытьё рук) — брать новорожденного не запрещается — грудное вскармливание не противопоказано
Персонал с проявлениями герпеса лучше удалить из акушерского и детского отделений.
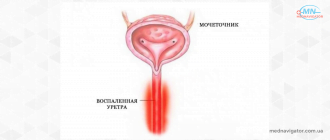
ГОНОРЕЯ.
Вызывается грам-отрицательным диплококком Нейссера. В природе существует только один хозяин гонококка-человек. Микроорганизм может существовать на слизистых оболочках, покрытых цилиндрическим, кубическим и плоским неороговевающим эпителием. Чаще всего поражаются оболочки мочеполового тракта. Организм очень чувствителен к условиям внешней среды. Оптимальными для развития микроорганизма являются следующие условия: рН=7,4, температура 35,50С, содержание СО2 в окружающей среде 2-10%.
Эпидемиология. Гонорея широко распространённое заболевание: ежегодно в мире регистрируется более 25 млн. новых случаев, при этом известно, что более половины всех случаев заболевания остаются нераспознанными. Женская Г. часто протекает бессимптомно, поражая эндоцервикс. У женщин наиболее высокая заболеваемость отмечается в возрасте 15-24-29 лет, в котором регистрируется 75-80% всех случаев заболеваемости. Заболеваемость у мужчин и женщин среди взрослого населения соотносится 1,5:1, но у подростков соотношение обратное с преобладанием заболеваемости среди женщин. У сексуально активных женщин в 15-19 лет она в 2 раза выше, чем в возрасте 20-24 года. Гонорея регистрируется у 1-2% женщин, осмотренных амбулаторно, у 5% женщин, находящихся на стационарном лечении, и у 0,5-7% беременных.
Передача ГН происходит почти исключительно через половые контакты. Чаще всего поражается эндоцервикс и уретра (70-90% при инфицировании эндоцервикса). Риск заражения у женщин выше, чем у мужчин. При одном половом контакте с больным партнёром риск заражения у мужчины составляет 20-25%, у женщины — 50-90%. При этом инкубационный период сокращается до 3-5 дней. В 1976 году впервые были обнаружены устойчивые к пенициллину штаммы ГН, обладающие специфическими В-лактамазами. В последующие годы отмечен рост числа таких штаммов: в 1988 г.-4%, в 1991 г.-13% всех исследований. С 1983 г. регистрируются штаммы с изменённым генетическим кодом, устойчивые не только к пенициллину, но и к цефалоспоринам, аминогликозидам, тетрациклинам.
Клинические проявления заболевания. Хотя большинство инфицированных женщин не имеет симптомов заболевания, но значительная их часть: до 40-60%,отмечают наличие выделений из влагалища, дизурию, межменструальные кровянистые выделения, меноррагии, чувство дискомфорта в области малого таза. У 15-20% инфицированных женщин впоследствии развиваются ОВЗМТ, обычно в конце или сразу после окончания менструации. Клиническая картина цервицита, вызванного ГН, не отличается от цервицита другой этиологии, и может сопровождаться явлениями уретрита, поражением желёз Скене и Бартоли.
Внеполовые формы заболевания включают поражение прямой кишки, конъюнктивы, глотки, перигепатит (синдром Фитц-Хью-Куртиса). Положительная культура ГН в прямой кишке выявляется у 30-50% женщин с шеечной гонореей, причём у 5% инфицированных это единственное место присутствия ГН. Среди женщин с присутствием ГН в половых путях у 10-20% он высевается из глотки, менее чем у 5% инфицированных это единственное место его присутствия.
Распространённые формы заболевания проявляются экстрагенитальными его проявлениями вследствие бактериемии. Их частота составляет 0,1-0,3% от всех случаев заболевания, причём у женщин в 4 раза чаще, чем у мужчин. Чаще заболевание проявляется в III триместре беременности или в пределах недели от начала менструации. Менее чем в половине случаев удаётся доказать специфическую этиологию заболевания путём выделения культуры возбудителя из внутренних сред организма (кровь, суставы). Этиология считается вероятной, если удаётся получить положительную культуру ГН из половых путей больного или его полового партнёра. Этиология считается возможной, если при отсутствии положительной культуры лечение оказывается эффективным.
Стадия бактериемии может сопровождаться ознобом, лихорадкой, артритом, дерматитом и такими редкими проявлениями заболевания, как эндокардит (с поражением аортального клапана) и менингит. Дерматит проявляется поражением кистей и пальцев, на которых появляются везикулы, превращающиеся в пустулы и, далее, бесследно исчезающие. Септический специфический артрит проявляется поражением коленей, кисти, голеностопных суставов. Кровь, как правило, стерильна. Синовиальная жидкость приобретает гнойный характер и содержит культуру ГН.
Офтальмия новорожденных известна с 1881 г., и до введения профилактики встречалась у 10% всех новорожденных. При инфицировании матери до 30-35% новорожденных при влагалищных родах инфицируются ГН. Заболевание обычно проявляется в первые 4 дня жизни, но возможен инкубационный период до 21 дня. Клинические проявления выражаются в двустороннем гнойном конъюнктивите, который при отсутствии лечения быстро прогрессирует до изъязвлений роговицы с последующим рубцеванием и слепотой.
Беременность. При наличии ГН в шейке матки возможны многочисленные осложнения беременности: внутриамниональная инфекция, преждевременное излитие вод (21-75%), преждевременные роды, аборты (11-35%), рождение недоношенных детей (17-67%), а также ЗРП, сепсис новорожденных и родильниц. Перинатальная смертность достигает 8-11%. Учитывая, что почти все инфицированные беременные не имеют симптомов заболевания, рекомендуется обследование всех беременных методом культуры при первой явке, и повторное обследование беременных группы риска в начале третьего триместра.
Диагностика. Не только беременные, но и большинство небеременных с гонореей не имеют симптомов заболевания. При первичном заражении наиболее часто поражается эндоцервикс. Окрашивание по Граму экссудата из потенциального очага инфекции (грамотрицательные диплококки внутри полиморфоядерных лейкоцитов) позволяет диагностировать заболевание у 95% мужчин, но только у 60% женщин. Для подтверждения заболевания у женщин необходимо выделение микроорганизма в культуре. В этом исследовании нуждаются все сексуально активные женщины. Но более реально проведение этого исследования в группах риска: заболевание у полового партнёра, признаки заболевания половых органов, ОВЗМТ, наличие других ИППП, многочисленные половые связи. Все беременные при первой явке должны пройти исследование на наличие гонореи методом культуры, у беременных из группы риска исследование повторяется в III триместре. Для выделения ГН используются селективные Среды типа Тайера-Мартина с ванкомицином, колистином, нистатином.
Культуральный метод при единственном посеве позволяет точно выявить заболевание в 80-90% случаев. Лучше использовать два последовательных забора материала из шейки матки или комбинацию материала из шейки матки и прямой кишки. Серологические методы исследования неэффективны ввиду наличия антител после предыдущих эпизодов заболевания. Поиск антигена ГН методом ELISA (Гонозим) имеет высокую Ч и Сп у мужчин с симптомами заболевания, но в отношении диагностики гонореи в шейке матки Ч и Сп метода низки, что исключает использование метода для скрининга заболевания при его распространении в популяции менее 1%.
Лечение. Как мужчины, так и небеременные женщины с неосложнённой гонореей не имеют различий в режимах лечения. ГН чувствителен ко многим антимикробным агентам, хотя в последние годы появились штаммы, устойчивые к антибактериальным средствам. Антибактериальные средства, применяемые сегодня, дают процент излеченности, превышающий 95%. Среди больных гонореей часто наблюдается коинфекция, так 15-25% мужчин и 30-50% женщин одновременно с ГН заражены C. trachomatis. Поэтому все пациенты, проходящие лечение по поводу гонореи, должны получать лечение против хламидий. Одновременно рекомендуется серологический скрининг на сифилис.
Лечение неосложнённой гонококковой инфекции
Рекомендуемые режимы:
Цефтриаксон (роцефин) в/м однократно 125 мг * лечение эффективно против сифилиса в инкубационном периоде
Цефиксим per os однократно 400 мг
Ципрофлоксацин per os однократно 500 мг
Офлоксацин per os однократно 400 мг * фторхинолоны не рекомендуется принимать беременным и кормящим матерям * беременные должны получать лечение цефалоспоринами или, при их непереносимости, спектиномицином в дозе 2,0 в/м.
Рекомендуется дополнительное лечение хламидийной коинфекции доксициклином в дозе 100 мг дважды в день в течение недели. Для беременных — эритромицин 500 мг (250 мг) четыре раза в день в течение 7 (14) дней.
Альтернативные режимы:
Спектиномицин (макролид) 2,0 в/м однократно
Цефтизоксим-500 мг в/м, Цефотаксим (клафоран)-500 мг в/м, Цефотетан-1,0 в/м, Цефокситин-2,0 в/м однократно.
Цефуроксим аксетил 1,0 или Цефподоксим прокстил 200 мг per os однократно.
Эноксацин 400 мг или Норфлоксацин 800 мг per os однократно.
После лечения неосложнённой гонореи в соответствии с рекомендуемыми режимами тест на излеченность не требуется (рекомендации Центра по контролю заболеваемости, США). При сохраняющихся симптомах заболевания необходимо повторное культуральное исследование с определением чувствительности ГН к антибиотикам. При лечении пациентов из группы риска, имеющих высокую вероятность реинфекции, рекомендуется повторное исследование на наличие ГН через 1-2 месяца. Половые партнёры больных ГН нуждаются в обследовании методом культуры и лечении до получения результатов обследования.
Лечение осложнённой гонореи.
Рекомендуемый режим:
Цефтриаксон 1,0 в/м или в/в раз в сутки
Альтернативные режимы:
Цефотаксим или Цефтизоксим 1,0 в/в через 8 часов
При непереносимости В-лактамных антибиотиков — Спектиномицин 2,0 в/м через 12 часов
Лечение проводится до признаков клинического улучшения и 24-48 часов после этого, далее, до истечения полной недели с начала лечения, возможны следующие режимы: Цефиксим 400 мг или Ципрофлоксацин 500 мг per os дважды в день. * Специфические менингиты и эндокардиты требуют в/в введения высоких доз Цефтриаксона: 1-2,0 через 12 часов. Лечение менингита продолжается 10-14 дней, эндокардита — до 4 недель.
Фарингеальная ГН лечится по схеме неосложнённой ГН. Через 4-7 дней проводится контроль излеченности методом культуры.
Офтальмия новорожденных требует изоляции больного ребёнка на 24 часа от начала лечения, которое проводится Цефтриаксоном в дозе 25-50 мг/кг/сут в/в или в/м в одной дозе в течение 7 дней (для взрослых-1,0 в/м однократно). Необходимо ежечасное промывание глаз физиологическим раствором до прекращения выделений.
СИФИЛИС.
Возбудителем является спирохета Treponema pallidum. В последнее десятилетие С. вновь принял форму эпидемии со значительным ростом заболеваемости беременных и случаев врождённого С. Выделяют первичный С. с формированием очага первичного поражения (шанкр), представляющего собой место проникновения возбудителя. Первичный очаг разрешается без лечения через 3-6 недель и заболевание переходит во вторичную стадию. Вторичный С.-системное заболевание (кожные проявления, ЛАП, бактериемия) длящееся 2-6 недель. Первые две стадии заболевания являются периодом размножения спирохет, когда наиболее вероятна передача болезни другому лицу.
Далее заболевание переходит в латентную фазу, не имеющую клинических проявлений. Латентная фаза считается ранней при длительности заболевания до 1 года. Третичный С. развивается у трети больных при отсутствии лечения и характеризуется прогрессирующим повреждением ЦНС, костно-мышечной системы, паренхиматозных органов (образование гумм характерно для позднего доброкачественного третичного С.). Treponema pallidum является исключительно анаэробным организмом, in vitro не растёт, но размножается в организме животных, особенно кроликов (возможность «прямых» мазков или серологической диагностики).
Эпидемиология. Считается, что на 1 выявленный случай заболевания С. приходятся 3 недиагностированных случая. В латентной фазе С. половым путём не передаётся, но возможна трансплацентарная передача плоду. У 25% больных без клинических проявлений С. возможны периодические обострения заболевания с появлением инфекционных очагов в виде поражений слизистых и кожи. В Российской Федерации сложилась крайне неблагоприятная эпидемиологическая ситуация по заболеваемости С., которая с 1989 г. по 1997 г. возросла в 64 раза и составляет 277,3 случая на 100 000 населения. При этом более половины больных — женщины. Рост темпов заболеваемости среди детей и подростков превышает таковые среди взрослых. В 1997 г. число детей и подростков, болеющих сифилисом, составило более 28 тысяч, каждый десятый из них — ребёнок до 14 лет. При этом 2/3 детей заразились половым путём, а у каждого четвёртого ребёнка выявлен врождённый сифилис. Заболеваемость С. среди подростков в возрасте 15-17 лет за последние 5 лет возросла в 47,4 раза.
Клиника. Инкубационный период С. длится от 10 до 90 дней. Первичный очаг, шанкр представляет собой безболезненную язву с плотным основанием. У женщин существуют сложности с выявлением шанкра, который может находится во влагалище, во рту, глотке, на шейке матки, сосках и анусе. Возможна ЛАП в виде изъязвления паховых лимфоузлов. Для вторичного С. характерно наличие макулопапулёзной генерализованной сыпи (70%), поражения ладоней, подошв (50%), точечные кровоизлияния в слизистые (21%), генерализованная ЛАП (85%), широкие кондиломы. При третичном С. возможно формирование аневризмы аорты и недостаточности аортального клапана, повреждение ЦНС: парезы, спинная сухотка, атрофия зрительного нерва, менинговаскулярный С., зрачок Аргил-Робертсона, не реагирующий на свет, но сохраняющий возможность аккомодации. Обычно третичный С. развивается через несколько лет заболевания, но его развитие с тяжёлыми неврологическими расстройствами возможно и намного раньше, особенно у больных с иммунодефицитом.
Врождённый С. Спирохеты проникают к плоду уже в 8 недель беременности, но клинические проявления у плода возможны только после 16 недель, когда появляется реакция иммунной системы. При первичном и вторичном С. ввиду наибольшего количества спирохет в крови матери имеется максимальный риск передачи заболевания плоду (в сравнении с латентной фазой). Инфицирование плода наступает в 100% случаев, признаки врождённого сифилиса отмечаются в 50%, неблагоприятные исходы беременности: мертворождение, недонашивание, неонатальная смертность- в 50% случаев. При раннем латентном С. врождённый С. встречается в 40%, перинатальная смертность — в 20%, недонашивание- в 20% случаев. При позднем латентном С. врождённый С. встречается в 10%, перинатальная смертность- в 11%, недонашивание- в 9% случаев. Существуют данные и о более высокой заболеваемости и смертности.
При раннем и позднем латентном С. в случаях вертикальной передачи новорожденные не имеют симптомов заболевания, которые появляются через 10-14 дней после родов. Шанкр не формируется, за исключением случаев, когда заражение произошло в родах. Характерные проявления раннего врождённого С. (начало заболевания в возрасте менее 2 лет) включают: макулопапулёзную сыпь (возможна буллёзная форма), заложенность носа с выделениями, точечные кровоизлияния в слизистую ротоглотки, гепатоспленомегалия, желтуха, ЛАП, остеохондрит с псевдопараличом Парро, хориоретинит, ирит. Поражения кожи и слизистых оболочек содержат спирохеты, видимые при исследовании в тёмном поле. Нелечённый или неизлеченный ранний врождённый С. прогрессирует до классических проявлений позднего врождённого С. : зубы Хатчинсона, моляры в виде плодов шелковицы, интерстициальный кератит, глухота (поражение 8 ч.-мозг. нерва), седловидный нос, саблевидные голени, неврологические проявления (умственная отсталость, гидроцефалия, генерализованные парезы, атрофия зрительного нерва).
Диагностика. Наиболее специфичным и чувствительным методом диагностики сифилиса является демонстрация трепонем в свежих пробах, полученных из очага поражения. Исследование в тёмном поле и прямая проба с флуоресцирующими антителами являются достоверными методами диагностики раннего сифилиса и проводятся только в случаях первичного и вторичного С. Пробы для исследования берутся из любого очага поражения, могущего быть шанкром или проявлением вторичного С.
Однако, большинство мужчин и почти все женщины, которым ставится диагноз С. обычно не имеют симптомов и находятся в латентной фазе заболевания. Поэтому чаще всего диагноз основывается на серологических тестах, которые подразделяются на два типа: неспецифические для антител реагин- типа и специфические для антител против трепонем. К первому типу относится реакция Вассермана, используемая для скрининга заболевания. Титры неспецифических тестов обычно связаны с активностью заболевания, поэтому их результаты должны оцениваться количественно. Увеличение титра в 4 раза указывает на значительные изменения. Несмотря на то, что реакция Вассермана не является высокочувствительным и специфичным тестом, высокий титр антител (более 1:16) обычно указывает на активный С.
Специфические тесты используются для подтверждения диагноза С. у пациентов с положительными неспецифическими тестами. К ним относятся: тест иммобилизации трепонем, тест абсорбции специфических флуоресцирующих антител, тест микрогемагглютинации. При появлении первичного очага (шанкр) как неспецифические, так и специфические серологические тесты отрицательны. Диагностическое значение имеет обнаружение спирохет при исследовании в тёмном поле отделяемого из очага. Через 4-6 недель у всех больных с первичным С. все серологические тесты становятся положительными и будут таковыми на протяжении вторичной и латентной фаз заболевания. Всем беременным с положительными неспецифическими тестами на С. должна проводится их количественная оценка, а также специфические тесты на С. К ложно-положительным результатам неспецифических тестов могут привести: вирусная инфекция, аутоиммунные заболевания (волчанка, ревматоидный артрит), употребление наркотиков и сама беременность. Однако, ложно-положительная реакция бывает, чаще всего, слабой. Примерно в 2% случаев первичного и вторичного С. избыток антител приводит к отсутствию положительной реакции ввиду невозможности формирования комплекса антиген-антитело. Поэтому у всех беременных с высоким риском заболевания С. необходимо разводить сыворотку, восстанавливая необходимую для положительной реакции концентрацию антител.
Диагностика бессимптомного нейросифилиса. При раннем (до 1 года) С., учитывая отличные результаты лечения даже при изменениях в спиномозговой жидкости, спиномозговая пункция не проводится. При длительности заболевания С. более 1 года спиномозговая пункция полезна: плейоцитоз, увеличение концентрации белка, положительная реакция Вассермана указывают на активный нейросифилис. Диагностика нейросифилиса невозможна с помощью какого-либо одного теста, диагноз ставится на основании комбинации серологических тестов и данных исследования спиномозговой жидкости, в частности, количество лейкоцитов в мм3, превышающее 5, указывает на активный нейросифилис.
Диагноз реинфекции или персистирующего активного С. может быть поставлен у пациента с анамнезом заболевания по динамике титра антител. При успешном лечении RW титр снижается и исчезает через 6-12 месяцев при ранних формах С., и через 12-18 месяцев при длительности заболевания более 1 года. Рост титра указывает на необходимость дополнительных диагностических мероприятий (пункция) и соответствующего лечения.
Врождённый С. нетрудно диагностировать у новорожденного с симптомами заболевания: желтуха, отёк клетчатки, большая отёчная плацента, подтвердив наличие трепонем исследованием в тёмном поле. Однако большинство инфицированных новорожденных не имеют симптомов заболевания при рождении, но их кровь из пуповины даёт положительную реакцию на С. по данным неспецифических тестов. Эта реакция может быть следствием наличия специфических антител у плода, перешедших к нему от матери (Ig G), или являющихся следствием его инфицирования (Ig M). Разделение этих типов антител представляет большие трудности. Если серопозитивность новорожденного является следствием пассивного перехода Ig G от матери, титры антител при реакции Вассермана неуклонно снижаются и исчезают в пределах 3 месяцев жизни. Любой новорожденный, имеющий положительную реакцию Вассермана при отсутствии клинических проявлений С., должен быть оценен с использованием этого теста ежемесячно в течение 9 месяцев. Подъём титра антител указывает на активный С. и необходимость лечения. Инфицированные новорожденные могут не иметь не только клинических, но и серологических признаков заболевания, если инфицирование метери произошло в поздние сроки беременности. Большинство клиницистов считают положительные неспецифические тесты (RW), подтверждённые трепонемспецифичными тестами из крови пуповины доказательством заболевания С., и приступают к лечению новорожденного.
Известны успешные попытки диагностики врождённого сифилиса путём исследования АЖ: определение спирохет при микроскопии в тёмном поле или заражение кроликов. При ультразвуковом исследовании плода подозрительными на С. являются гепатоспленомегалия, большая плацента, непостоянная непроходимость кишечника, признаки неиммунной водянки плода.
Лечение. Подлежат обязательному лечению: * вступавшие в половой контакт с лицом, имеющим подтверждённый диагноз С. * лица с положительными данными микроскопии в тёмном поле * лица с положительными результатами серологических трепонемспецифических тестов * лица, у которых диагноз С. не может быть отвергнут с полной определённостью * лица, лечившиеся по поводу С., но имеющие признаки реинфекции: очаги поражения, в которых найдена трепонема при исследовании в тёмном поле, 4-х кратный подъём титра антител при неспецифических тестах.
Лучшим методом лечения С., что доказано полувековым клиническим экспериментом, является парентеральное введение пенициллина. Форма препарата, доза и длительность лечения зависят от стадии С. и его клинических проявлений (Приложение 2). При нейросифилисе и беременности парентеральное введение пенициллина является единственным видом лечения с доказанной эффективностью. Все пациенты, проходящие лечение от С. должны быть проверены на наличие ВИЧ. При высокой вероятности ВИЧ-инфекции лица с первичным С. должны быть обследованы на ВИЧ повторно через 3 месяца. При наличии у пациента симптомов, указывающих на возможность поражения ЦНС или глаз необходимо провести обследование с применением, соответственно, спиномозговой пункции или щелевой лампы.
При первичном и вторичном С оценка эффективности лечения основана на серологических тестах и клинических данных. В случае первичного и вторичного С. пациент обследуется клинически и серологически через 3 и 6 месяцев после лечения. Титр антител при RW должен снизиться в 4 раза через 3 месяца после лечения. Если этого не происходит, то возможно лечение было неэффективным, а пациента следует обследовать на наличие ВИЧ-инфекции. Подобные пациенты нуждаются в динамическом серологическом и клиническом обследовании. Если это невозможно следует повторить курс лечения.
Лица с сохраняющимися или рецидивирующими симптомами заболевания 4-х кратным подъёмом титра антител при RW должны после оценки на ВИЧ пройти повторное лечение ввиду неэффективности предыдущего курса или реинфекции. Повторный курс лечения состоит из 3 еженедельных внутримышечных инъекций бензатин пенициллина в дозе 2,4 млн. ед., если результаты спиномозговой пункции не указывают на наличие нейросифилиса.
Лечение латентного С. направлено на предупреждение третичного С. Пациенты, имеющие С. неустановленной продолжительности, ведутся как больные с поздним латентным С. с длительностью заболевания более 1 года.
У лиц с латентным С., имеющим аллергию к пенициллину, лечение другими антибиотиками возможно только после исключения нейросифилиса при исследовании спиномозговой жидкости. Применяются препараты доксициклина и тетрациклина. При раннем латентном С. лечение проводится 2 недели, при позднем- 4 недели. Беременные должны быть пролечены пенициллином после десенситизации.
Частота выявления нейросифилиса по данным исследования спиномозговой жидкости у лиц с латентным С. низка, поэтому рутинное проведение спиномозговой пункции не рекомендуется. Однако она целесообразна:
– при наличии признаков поражения нервной системы или глаз — при наличии других проявлений активного С.: аортит, ирит, гуммы — неэффективность лечения или наличие ВИЧ-инфекции — титр RW равный или более 1:32 при длительности заболевания более 1 года — при планируемой терапии без использования пенициллина при длительности заболевания более 1 года.
Эффективность лечения пациентов с латентным С. требует количественной оценки неспецифических серологических тестов через 6 и 12 месяцев. Исследование на нейросифилис и повторное лечение необходимо, если
– титры антител возрастают в 4 раза — титра антител перед лечением равны или превышают 1:32 и за 12-24 месяца после лечения не снижаются в 4 раза — у пациента присутствуют клинические симптомы заболевания.
Пациенты с признаками позднего (третичного) С при аллергии к пенициллину лечатся по схеме, рекомендованной для позднего латентного С. Лечение беременных проводится только пенициллином, при необходимости-после десенситизации.
Признаки поражения ЦНС могут появиться при любой стадии болезни. Поэтому все пациенты с С., у которых имеются признаки поражения глаз, слуха, параличи черепно-мозговых нервов должны пройти исследование спиномозговой жидкости. У беременных лечение пенициллином эффективно как для предупреждения передачи заболевания плоду, так и для лечения инфекции, развившейся у плода. Следует заметить, что высокие титры антител при RW на момент установления диагноза и неустановленная длительность заболевания указывают на значительный риск рождения ребёнка с врождённым С., несмотря на лечение матери. При лечении С. после 20 недель беременности существует риск преждевременного родоразрешения и дистресса плода, если лечение сопровождается реакцией Яриш-Хексгеймера. Наблюдение за результатами лечения при беременности проводится ежемесячно с использованием титров неспецифических серологических тестов. Новорожденные от серопозитивных матерей должны быть обследованы на наличие врождённого сифилиса, если
– лечение С. у матери не проводилось или проведено только эритромицином — лечение С. у матери закончено менее, чем за месяц до родов — лечение проведено адекватными дозами пенициллина, но титры антител при неспецифичесом серологическом тесте снизились менее чем в 4 раза — лечение С. при беременности не подтверждено документально должным образом — лечение С. проведено правильно до беременности, но нет соответствующей серологической оценки результатов лечения.
Если мать получила адекватное лечение пенициллином в ранних сроках беременности, врождённый С. встречается крайне редко. Новорожденным лечение назначается, если лечение матери было неправильным, если о нём ничего неизвестно, если оно проведено без применение пенициллина или наблюдение за новорожденным в дальнейшем невозможно. У любого новорожденного с подозрением на врождённый С. перед лечением необходимо провести исследование спиномозговой жидкости. При нормальных результатах исследования следует однократно ввести внутримышечно бензатин пенициллин в дозе 50 тыс. ед./кг массы новорожденного. Если результаты патологические или исследование не проводилось новорожденному следует назначить водный раствор кристаллического пенициллина в дозе 50 тыс. ед./кг массы ежедневно в течение 10 дней.
При одновременном инфицировании ВИЧ у больных С. с длительностью заболевания менее 1 года имеется повышенный риск поражения ЦНС, чаще встречаются неудачи в лечении. Однако, риск этих осложнений не является высоким, поэтому рекомендуемое лечение при первичном и вторичном С. остаётся неизменным. При латентном С. у лиц с ВИЧ-инфекцией спиномозговая пункция является обязательной до начала лечения. При отсутствии признаков нейросифилиса проводится лечение бензатин пенициллином в трёх еженедельных инъекциях до общей дозы 7,2 млн. ед. При лечении любых стадий С. у ВИЧ-инфицированных используются только препараты пенициллина, при необходимости-после десенситизации.
Канкроид («мягкий» шанкр).
Вызывается организмом, передающимся половым путём, и вызывает изъязвления на половых органах, часто сочетающуюся с паховой аденопатией (бубон). Возбудитель — Haemophilus ducreyi-бактерия в виде маленькой неподвижной грамотрицательной палочки, образующей, при окраске по Граму, характерные цепочки в виде «стаи рыбок», факультативный анаэроб, условия роста которого напоминают таковые для ГН: высокая влажность, повышенное содержание СО2, температура 33-350C.
Заболеваемость канкроидом в мире выше, чем С., он встречается в основном в странах третьего мира, и в отдельных районах встречается чаще, гонорея. Болеют чаще молодые необрезанные мужчины с низким СЭС. Примерно 10% больных К. могут быть заражены С. или ВПГ. К тому же это заболевание является кофактором гетеросексуальной передачи ВИЧ.
Инкубационный период длится 3-10 дней, чаще 4-7 дней. Присутствие очагов поражения ограничивается половыми органами (половые губы, клитор, своды влагалища). В месте внедрения возбудителя образуется маленькая папула, окружённая зоной эритемы. Через 2-3 дня папула превращается в пустулу и, затем, в болезненную язву с дном, покрытым некротическим экссудатом, и красным ободком воспаления. У половины больных через 7-10 дней после появления первичного очага развивается чаще односторонняя (в 2/3 случаев) болезненная паховая аденопатия (бубон), которая позже изъязвляется.
Диагноз ставится чаще всего на основании клинических проявлений, по результатам окраски по Граму пункционного материала из бубона (чувствительность 50%), по данным культурального исследования. Всегда необходимо помнить о возможности присутствия других ИППП.
Лечение проводится для обоих партнёров азитромицином 1,0 per os однократно, или цефтриаксоном в/м 0,25 однократно, или амоксициллином-0,5 с клавулановой кислотой-0,125 (Уназин) per os трижды в день в течение 7 дней, или ципрофлоксацином per os по 0,5 дважды в день в течение 3 дней. Для беременных рекомендуется лечение эритромицином по 500 мг 4 раза в день в течение недели.
Лимфогранулёма венерическая.
Распространена преимущественно в тропических странах. Возбудитель — Chlamidia trachomatis, серотипы L 1-3. Инкубационный период составляет 3-21 день. Первичный очаг локализуется на вульве, шейке матки, в сводах влагалища, и поэтому обычно не замечается пациентом. Он представляет собой безболезненные везикулы или папулы, которые позже изъязвляются. Через 1-4 дня после появления первичного очага наступает вторичная стадия, описываемая как «паховый синдром»: односторонний болезненный лимфаденит с формированием бубона, который разрывается у трети больных, или как «аноректальный синдром»: симптомы проктита, что чаще встречается у женщин и мужчин-гомосексуалов. Возможны общие симптомы: лихорадка, головная боль, миалгия. Третичная стадия заболевания характеризуется процессами разрушения и рубцевания тканей аноректальной зоны, стриктурами, слоновостью.
Диагноз ставится на основании клинических проявлений, культурального метода исследования (чувствительность 50%), реакции фиксации комплемента: титр антител к соответствующим серотипам хламидий равен или превышает 1:64.
Лечение проводится для обоих партнёров доксициклином per os по 100 мг дважды в день в течение 21 дня. Для беременных рекомендуется лечение эритромицином per os по 500 мг 4 раза в день в течение 21 дня.
Паховая гранулёма (донованоз).
Распространена в тропических странах и вызывается Callymmatobacterium granulomatis: грамотрицательной, неподвижной, неспрообразующей палочкой, относящейся к группе Enterobacteriaceae. Передаётся как половым, так и неполовым путём: через кишечник. Клинические проявления представлены безболезненными папулами в аногенитальной области, которые затем изъязвляются, без паховой аденопатии. Возможно поражение полости рта. Диагноз ставится на основании клинических проявлений или обнаружения телец Донована в макрофагах из мазков или биопсийного материала очага поражения (окраска по Гимзе). Серологических методов диагностики не разработано. Культуральный метод применяется редко и представляет собой культивирование материала из очага поражения на желточных мешках куриных эмбрионов с последующей гистологической идентификацией возбудителя.
Лечение проводится до исчезновения поражений тетрациклином per os по 500 мг 4 раза в день в течение 3-4 недель. Препаратами резерва являютcя: хлорамфеникол (левомицетин), per os по 500 мг трижды в день, и гентамицин в/м в дозе 1 мг/кг дважды в день.
Вирус папилломы человека.
ДНК-содержащий вирус, насчитывающий более 60 типов, относящийся к семейству паповирусов, характеризуется способностью инфицировать и изменять клетки эпителия. Типы вируса 6, 11,16,18, 31, 33, 35, 39 вызывают образование кондилом (бородавок) на половых органах. Наиболее часто остроконечные кондиломы (condyloma acuminatum) вызываются типами 6 и 11. Типы 16 и 18 связаны с новообразованиями половых органов: тип 16 ВПЧ выделен при дисплазии шейки матки III степени в 47%, и при раке шейки- в 47% случаев. Тип 18 ВПЧ выделен, соответственно, в 5% и 27% случаев. ДНК вируса обнаружена у 10-11% женщин в шейке матки при нормальных результатах цитологического исследования (окраска по Папаниколау), и в 91-92% случаев при патологических данных цитологического исследования.
Эпидемиология. Передаётся половым путём, вероятность заражения партнёра составляетя 65-70%, мужчины и женщины инфицируются в равной степени, инкубационный период составляет 2-3 месяца. Инфекция у беременных может явиться причиной респираторного папилломатоза у новорожденных, вызываемого типами вируса 6 и 11. Возможные пути передачи: трансплацентарный, контакт с тканями родового канала, инфицирование после родов. Очень небольшая часть детей, рождённых инфицированными матерями заболевают респираторным папилломатозом. Риск передачи ВПЧ от инфицированной матери новорожденному составляет примерно 1:1000. Время начала клинических проявлений заболевания весьма вариабельно: только в 25% случаев оно развивается в пределах года после рождения, и в 50% случаев-в возрасте до 3 лет, что предполагает инфицирование ВПЧ после родов.
У взрослых факторами риска инфицирования ВПЧ являются: число половых партнёров, курение, длительное применение оральных контрацептивов. Не существует ни одного клинического или лабораторного метода исследования, точно указывающего на инфицирование ВПЧ. Отсутствуют доступные серологические тесты, методика культивирования вируса не разработана. Поэтому считается, что большинство случаев инфицирования ВПЧ не сопровождается клиническими проявлениями. Хотя, по некоторым данным, инфицирование ВПЧ встречается в 2 раза чаще, чем ВПГ, и кондиломы, как следствие ВПЧ-инфекции, являются третьим по частоте ИППП после гонореи и негонококкового уретрита, в настоящее время признаётся, что большинство случаев инфицирования ВПЧ протекают субклинически и могут распознаваться только при кольпоскопии, цитологическом исследовании, методом биопсии или с применением техники ДНК-гибридизации. При том, что число инфицированных ВПЧ точно неизвестно, кондиломы встречаются примерно у 1% инфицированных, ещё 2% случаев с субклинической инфекцией могут быть выявлены при кольпоскопии.
Современные данные указывают на частоту кондилом в зависимости от особенностей изучаемой группы населения от 0,5% до 3%. Наличие дисплазии шейки матки увеличивает выявление кондилом на вульве или шейке матки до 3-7%. Считается, что ещё 6-12% всех женщин имеют латентную инфекцию ВПЧ, из них только у 10% появляются кондиломы, развивается дисплазия или рак шейки матки. Иммуносупрессивные состояния повышают частоту клинических форм инфекции, ускоряют развитие дисплазии шейки матки. К ним относятся: пациенты после пересадки органов, беременные, инфицированные ВИЧ.
Клиническими проявлениями заболевания являются остроконечные кондиломы аноректальной и урогенитальной зоны: уретра, промежность, анус, прямая кишка, вульва, влагалище, шейка матки («плоские» кондиломы). Кондиломы, как правило, себя не проявляют, но, будучи ломкими, могут кровоточить. У женщин К. чаще располагаются на наружных половых органах и промежности. Но до 50% женщин с поражением вульвы имеют кондиломы на шейке матки, которые видны при кольпоскопии и белеют при обработке 5% уксусной кислотой.
Диагноз ставится на основании: а) клинических проявлений, б) гистологического исследования, в) данных кольпоскопии (картина неспецифична), г) определения ДНК вируса методом гибридизации (инструмент научного исследования).
Лечение. Полное уничтожение вируса невозможно, поэтому лечение имеет в основном косметическую цель. Оно достаточно утомительно для пациента, болезненно, дорого и часто неэффективно. У 20-30% больных кондиломы исчезают в пределах 3 месяцев после появления без лечения. Удаление кондилом возможно в 22-94% случаев в зависимости от метода лечения, но в пределах 3 месяцев после лечения частота рецидива обычно превышает 25%.
Лечение с применением жидкого азота эффективно в 63-88%, частота рецидива составляет 21-39%. Подофилокс (кондилокс)- наиболее биологически активная составляющая подофиллина, применяется местно в виде 0,5% раствора, малотоксичен, его не надо смывать после аппликации. Эффективность лечения составляет 45-88%, частота рецидива через 3 месяца — 33-60%. Применение при беременности не изучено. Не рекомендуется к применению при кондиломах уретры, прямой кишки и влагалища.
Подофиллин в виде 10-25% раствора применяется местно, обязательно медработником, до 6 аппликаций ежедневно, смывается через 1-4 часа после аппликации. Эффективность лечения составляет 22-32-79%, частота рецидива — 11-27-65%. Ввиду возможной токсичности и тератогенности при беременности противопоказан. Трихлоруксусная кислота для местных аппликаций в виде порошка может использоваться при беременности ежедневно до 6 процедур. Эффективность лечения равна таковой у подофиллина: 35-94%, как и частота рецидива 11-22-36%. Лучшими методами удаления кондилом при беременности являются хирургический, криодеструкция, электрокаутеризация, а также лазеротерапия, хотя метод дорог, а его эффективность составляет 23-40%. Местное и системное применение интерферона крайне дорого, а результаты лечения не лучше, чем при других методиках.
Пациентов с субклиническими формами по данным цитологии, кольпоскопии, биопсии, без формирования кондилом, лучше оставить без лечения. При наличии дисплазии шейки матки лечение зависит от её стадии. Обследование половых партнёров женщин с кондиломами или субклиническими формами инфекции не рекомендуется, так как они считаются уже инфицированными. Применение презерватива уменьшает вероятность инфицирования ВПЧ. Практически значимого теста для скрининга инфекции не существует. Наличие кондилом на половых органах или субклинические формы инфекции не являются показанием для операции кесарева сечения, ввиду низкой заболеваемости новорожденного, а также возможности внутриутробного и постнатального его инфицирования. Оперативное родоразрешение может быть необходимым при больших размерах кондилом, обтурирующих родовые пути и угрожающих кровотечением.
Вирусы гепатита.
Вирус гепатита А является РНК-содержащим пикорнавирусом, относящимся к энтеровирусам. Главный путь передачи- орально-фекальный, но возможна его передача через половой контакт. Поэтому, при остром гепатите у полового партнёра, вызванного ВГА, рекомендуется профилактическое внутримышечное введение в пределах 2 недель от контакта иммуноглобулина (гаммаглобулина) в дозе 0,02 мл/кг массы (1,5-2 мл). Возможность перинатальной передачи вируса не доказана. Изоляция больных не требуется, хотя нужно помнить, что их фекалии являются источником заражения.
Вирус гепатита Б содержит ДНК. Специфичными для ВГБ являются три антигена: HBsAg, HBcAg и HBeAg. Присутствие последнего указывает на высокую инфекционность и высокий риск передачи ВГБ, так у беременных с наличием этого антигена значительно чаще (до 90%) происходит инфицирование плода. Инфицирование ВГБ происходит почти исключительно при контакте с жидкими тканями больного: кровь, сперма, шеечно- влагалищный секрет, когда вирус проникает через дефекты в эпителиальных покровах. В развитых странах наиболее важным путём передачи вируса являются половые контакты, в развивающихся странах третьего мира- вертикальная передача в перинатальный период. Наиболее важным инструментом диагностики ГБ является определение HBsAg в сыворотке крови. Антиген, характерный для ГБ, присутствует у населения развитых стран с частотой 1:1000, но в развивающихся странах может встречаться с частотой 2-25%. Наиболее часто встречающаяся форма инфекции- бессимптомное присутствие HBsAg в плазме крови при нормальных показателях функций печени. До 70% женщин детородного возраста чувствительны к инфекции ВГБ, а частота острого и хронического гепатита среди беременных составляет, соответственно, 1-2 / 100 и 5-15 / 1000.
Передача ВГБ плоду может осуществляться: 1) трансплацентарно, 2) в родах (основной путь передачи), 3) после родов, 4) через грудное молоко или молозиво. Примерно 80-90% новорожденных от матерей, заболевших ГБ в III триместре, имеют специфический антиген в сыворотке крови, при заболевании матери ГБ в ранних сроках беременности передача вируса новорожденному происходит в 10% случаев. Длительное присутствие HBsAg в сыворотке крови связано с наличием хронического гепатита и цирроза печени. В развитых странах при хроническом носительстве HBsAg инфицируются до 10% новорожденных, в развивающихся странах Азии — до 30-40%. В то же время почти все дети, рождённые матерями, имеющими HBeAg, инфицируются в течении первого года жизни, и 85% из них становятся хроническими носителями HBsAg.
У беременных с острым гепатитом число абортов в 1 триместре и преждевременных родов увеличивается, но не превышает уровень невынашивания при других лихорадочных состояниях. Наличие хронического носительства HBsAg не влияет на перинатальные исходы. Хотя трансплацентарный переход вируса доказан, его присутствие у плода не вызывает аномалий развития.
Диагностика. Клинические проявления острого ГБ такие же, как и при ГА. Инкубационный период составляет 60-180 дней. Диагноз острого гепатита подтверждается серологически: присутствием в плазме крови HBsAg и соответствующего Ig M. Антиген появляется в крови в инкубационный период, присутствует в период клинических проявлений заболевания и исчезает после выздоровления. Примерно 5-10% больных остаются хроническими носителями вируса. У инфицированных новорожденных клинические проявления заболевания редки, чаще оно протекает в виде бессимптомного хронического гепатита с наличием HBsAg в крови, повышением содержания энзимов печени, гистологическими признаками гепатита. При бессимптомном течении заболевания примерно у 10% детей на 3-4 месяце жизни может появиться желтуха.
Лечение. Специфического лечения не существует. Рекомендуются: постельный режим, обогащённая белком диета, избегать медикаментов с гепатотоксичным действием.
При отсутствии специфического лечения возможна профилактика заболевания, которая состоит в пассивной иммунизации специфическим иммуноглобулином или активной иммунизации вакциной. Женщины при установленном контакте с ВГБ должны быть тестированы на наличие специфических антител. При их отсутствии как можно скорее вводится иммуноглобулин в одной инъекции в дозе 0,06 мл/кг. После введения иммуноглобулина следует провести вакцинацию. Подобная тактика предупреждает инфицирование новорожденного в 85-95% случаев.
Все беременные должны пройти обследование на носительство HBsAg. При положительном результате всем новорожденным этих женщин должен быть введён иммуноглобулин в дозе 0,5 мл в/м с последующей вакцинацией в пределах 12 часов жизни. Дополнительное введение вакцины производится в возрасте 1 и 6 месяцев. Если обследование матери на наличие HBsAg не проводилось, она рассматривается как инфицированная, а новорожденному вводится иммуноглобулин и проводится вакцинация. Необходимость введения вакцины в дальнейшем зависит от данных обследования матери. При установленном контакте с ВГБ иммунизация и вакцинация медицинского персонала также является обязательной.
Все жидкие ткани тела носителей HBsAg следует рассматривать как источник заражения. Для персонала рекомендуется ношение масок, перчаток, очков. Изоляция новорожденных от матерей, носителей HBsAg не требуется, разрешается кормление грудью, но при трещинах сосков грудное вскармливание целесообразно прекратить.
Вирус гепатита С передаётся парентерально во время трансфузий. Инкубационный период составляет 30-60 дней. Частота вертикальной передачи составляет менее 10%. В основном: 75%, протекает бессимптомно, но у половины больных заболевание становится хроническим. Из них, примерно у 20-25% оно заканчивается развитием цирроза или рака печени. Частота у беременных такая же как и в общей популяции: 1,5-2%. Беременность не влияет на течение гепатита, а он — на состояние матери и плода. При хронических формах возможно повышение частоты ЗРП и недонашивания. Диагностика может проводится методом ELISA, что не позволяет различать Ig M и Ig G, характерные для острого или длительно текущего гепатита. Возможно применение метода ПЦР, устанавливающего наличие виремии. Специфического лечения и вакцинации не существует. Применение интерферона приостанавливает развитие инфекции в 40-50% случаев, но частота рецидива через 6-12 месяцев составляет 44-80%. Обследование беременных, за исключением случаев повышенного риска, не проводится. Синдром приобретенного иммунодефицита человека
Возбудитель заболевания — вирус, выделен в 1983 г. (семейство ретровирусов), и с 1986 г. называется вирусом иммунодефицита человека (ВИЧ). Описано два его типа ВИЧ-1, имеющий по меньшей мере 10 генетических субтипов, и ВИЧ-2, впервые выделенный у пациентов из Западной Африки, но в настоящее время выделяется у больных СПИД во всем мире. Его трансмиссивность ниже, чем у ВИЧ-1, а течение заболевания более медленное. Возможно инфицирование больного обоими типами вируса одновременно.
Сегодня СПИД выходит на ведущие позиции в мире, как причина смерти. В 2000 г. число заболевших во всем мире превысило 40 млн., причем большинство составляют дети и женщины. Среди инфицированных ВИЧ женщин 85% находятся в репродуктивном возрасте, а 90% случаев заболеваний детей происходит вследствие передачи вируса в перинатальный период от инфицированной матери. Клинические проявления ВИЧ инфекции
СПИД — летальная конечная стадия широкого спектра заболеваний, вызванных ВИЧ, верхушка “айсберга”, и представляет меньшинство инфицированных ВИЧ. В категорию СПИД попадают все лица с числом СД 4 (+) Т-лимфоцитов менее 200 в мл или менее 14% от их общего числа (Приложение 3). К перечню болезней, указывающих на СПИД (клиническая категория С), в 1993 г. добавлены три заболевания: инвазивный рак шейки матки (менее 1%), возвратная пневмония (1%), туберкулез легких (9%). Для гинекологов будет важно то, что в категорию В включены: кандидоз вульвы и влагалища (упорный, частый), дисплазия шеечного эпителия (умеренная и тяжелая), воспалительные заболевания малого таза, особенно, осложненные тубоовариальным абсцессом. У женщин наиболее характерны следующие заболевания, указывающие на СПИД: пневмоцистная пневмония, кандидоз пищевода, синдром усталости, криптококковый менингит, бронхит, вызванный вирусом герпеса (или пневмония, или эзофагит, или изъязвления, не исчезающие более 1 мес.), цитомегаловирусная инфекция, туберкулез, токсоплазмоз ЦНС, лимфома. Этиология и патогенез
Жизненный цикл вируса начинается со связывания с клеткой хозяина. Инфицируются клетки, имеющие СД 4 антигенный комплекс- преимущественно Т-лимфоциты (хелперы), а также В-лимфоциты, промиелоциты, эпителий кишечника, астроциты мозга, эндотелий капилляров, моноциты/макрофаги. Могут поражаться и СД 4 (-) нервные клетки. После слияния мембран клеток и проникновения вирусной частицы внутрь клетки хозяина происходит обратная транскрипция генома вируса, и его ДНК-копия проникает в ядро клетки и интегрируется в хромосомы. После этого за счет ресурсов инфицированной клетки начинается синтез вирусной ДНК, белков нового вируса, его “созревание” и выделение из клетки хозяина. Популяция СД 4 инфицированных лимфоцитов удваивается каждые 15 дней.
ВИЧ выявляется и вне клеток: в плазме- у 30% инфицированных, но в низких титрах (10-50 частиц вируса в 1 мл). При ВГБ в 1 мл крови находится до 10 млрд. частиц вируса, что делает риск заражения при уколе иглой намного выше, чем при ВИЧ инфекции. В спинномозговой жидкости количество вирусных частиц ВИЧ значительно выше-1000 в 1 мл. С другой стороны, влагалищные, шеечные секреты, семя содержат частиц ВИЧ значительно меньше, чем кровь. То же относится к слезам и слюне: 1/10-1/100 от количества частиц вируса в крови.
Передача заболевания происходит не через жидкость, где мало свободного ВИЧ, но через инфицированные клетки, которых много в семени, секретах влагалища и шейки матки, и которые “защищают” вирус от иммунной системы хозяина, что может создавать проблемы с лечением. Переходу инфекции от латентного состояния к активному могут предположительно способствовать вирусы цитомегалии, герпеса, гепатита Б, Эпштейна-Барра, неизвестные факторы, содержащиеся в семени и крови. С началом размножения ВИЧ инфицированная клетка гибнет, происходит слияние мембран и образование гигантских многоядерных клеток.
Количество СД 4 (+) клеток уменьшается на 25-40 кл/мкл в год. Когда уровень СД 4 (+) клеток снизится менее 300 кл/мкл, виремия вновь возрастает, а у больного появляются симптомы заболевания, в том числе связанные с разрушением системы иммунитета оппортунистические инфекции и злокачественные заболевания, определяющие диагноз: СПИД. Больному остается до смерти, даже при противовирусном лечении, около 2 лет. ”Поведение” вируса отличается от первых лет инфекции: он становится более “агрессивным”, быстрее размножается, устойчив к лечению. Количество антивирусных клеток СД 8 (+): лимфоцитов-киллеров — снижается. Клиническая категория А
Характеризуется гриппоподобными заболеваниями, которые могут быть и не связаны с ВИЧ инфекцией, распространенных в эндемических районах и группах риска. Инкубационный период ВИЧ инфекции составляет от 3 дней до 3 месяцев (3-6 недели). Затем появляется комплекс симптомов, напоминающих «мононуклеоз»: лихорадка, поты, сонливость, недомогание, миалгия, артралгия, головные боли, понос, ангина, ЛАП (лимфоаденопатия), макулопапулезная сыпь на теле. Начало заболевания внезапное, что не характерно для мононуклеоза. Возможны также неврологические симптомы, патологические функциональные пробы печени. Диагноз ставится по факту сероконверсии: появляются антитела к ВИЧ.
Далее наступает бессимптомное состояние длящееся 7-11 лет, после чего наступает явный иммунодефицит (у половины больных через 5-6 лет). Часто единственным симптомом заболевания может быть иммунная тромбоцитопеническая пурпура (синяки, петехии), ЛАП (более 3 месяцев), иногда- общие симптомы: лихорадка, ночные поты. Если к указанной симптоматике присоединяется кандидоз полости рта, лейкоплакия губ, то через 6-14 месяцев следует ожидать развернутого синдрома СПИД. К клинической категории А принадлежит большинство ВИЧ инфицированных. Клинические категории В и С
Представлены симптомной инфекцией. Неврологическая симптоматика, характерная для категории С, встречается весьма часто и, возможно, является следствием прямого воздействия ВИЧ на нервную систему человека: 40-80% умерших от СПИД имели гистологические признаки патологии ЦНС. Ни один метод исследования не может предсказать время перехода ВИЧ инфекции от бессимптомного к симптомному течению (СПИД). Но все же следует обращать внимание на: снижение гематокрита, числа Т-лимфоцитов (хелперов), повышение числа Т-супрессоров, низкий уровень антител к ВИЧ, повышение титра антител к ЦМВ, анамнез прогрессирующего СПИД у полового партнера. Диагностика ВИЧ-инфекции
Важно выявить ВИЧ инфекцию до развития СПИД: оказание ранней медицинской помощи и профилактика осложнений; замедление прогрессирования заболевания при его лечении; снизить вероятность передачи ВИЧ другому лицу; у беременных лечение инфекции снижает вероятность вертикальной передачи ВИЧ.
Метод иммунофлуоресценции используется редко: дорого, долго, требуется большой опыт исследователя. То же относится к радиоиммунопрецепитации.
Культуральный метод: дорого (требуются меры биологической защиты), долго (более 1 месяца), чувствительность- неизвестна. В клинической практике не применяется.
Наиболее распространенным является поиск антител к ВИЧ методом иммуносорбции (ELISA). Метод обладает высокой чувствительностью и специфичностью, однако на ранних этапах инфекции антитела отсутствуют (феномен “окна”). Прогностическая ценность метода зависит от распространенности ВИЧ в исследуемой группе и снижается в общей популяции, где частота инфекции невысока. При положительном результате теста рекомендуется проводить проверочные исследования, например, Western blot-метод хроматографии на геле, изолирующий антигены ВИЧ: белки сердцевины и оболочки вируса. Возможен поиск антигенов вируса с использованием моноклональных антител. Эти методы более точны, т. к. ВИЧ может размножаться в отсутствие антител к нему. Это “окно” существует только несколько недель, но в отдельных случаях-до 6-14 месяцев перед сероконверсией.
Метод полимеразной цепной реакции (ПЦР) дает возможность распознавания малых количеств ДНК ВИЧ: 1 копия на 100 000 клеток. В общей клинической практике метод применяется пока редко: в основном у новорожденных, для контроля за лечением ВИЧ инфекции и для раннего выявления ВИЧ у женщин, подвергавшихся сексуальному насилию.
В настоящее время наиболее надежным прогностическим маркером инфекции стал уровень РНК ВИЧ. Показано, что риск развития клинических проявлений (СПИД) и смерти прямо связан с исходным уровнем РНК ВИЧ в крови. Этот показатель оказался лучшим прогностическим тестом, чем число СД 4 лимфоцитов. Определение уровней РНК ВИЧ позволило оценить медиану выживаемости больных: при уровне менее 5 000 копий/мл прогнозируемая продолжительность жизни превышала 10 лет; при уровне 5-13 тыс. копий/мл средняя продолжительность жизни составляла 9,5 лет; при уровне 13-36 тыс. копий/мл — 7,4 года; а при уровне более 36 тыс. копий/мл — 5,1 лет.
Сегодня сложилось следующее представление о течение ВИЧ инфекции. Сразу после заражения вирус начинает бурно размножаться в крови, что сопровождается активной иммунной реакцией. После такого “периода возбуждения“, продолжающегося около 6 месяцев, содержание вируса стабилизируется на высоком или низком уровне. Высокие цифры свидетельствуют о плохом прогнозе, а низкие — о более медленном прогрессировании заболевания. Эпидемиология у женщин
Наиболее распространенная причина ВИЧ инфицирования среди мужчин остаётся гомосексуальная связь. В то же время у женщин наиболее частой причиной инфицирования ВИЧ является в/в употребление наркотиков-48%, далее следовали гетеросексуальные контакты- 36-38% (для мужчин — 3%), гемотрансфузия — 5% (для мужчин-1%). Женщины являются наиболее “быстрорастущей” группой ВИЧ инфицированных.. В мире происходит сдвиг от инъекционного пути передачи вируса к гетеросексуальному. Вследствие гетеросексуальных контактов в афро-азиатском регионе соотношение ВИЧ инфицированных мужчин и женщин составляет 1:1. По данным ВОЗ в 1989 г. в мире насчитывалось около 3 млн. женщин с ВИЧ инфекцией, к 2000 г. их число возросло до 13 млн. Трансмиссивность
Риск передачи ВИЧ при половых контактах точно неизвестен. Но известно, что ВИЧ передается половому партнеру с меньшей частотой в сравнении с другими ЗПП: гонорея, хламидиоз, сифилис. Уровень серопозитивности среди постоянных половых партнеров лиц, инфицированных ВИЧ, составляет 7-68%. Для женщин имеет значение количество половых контактов (более 100- до 31% инфицирования), анальный секс (38%), использование кондома (10% против 80 — 90%).
Подсчитан риск заражения ВИЧ на 1 половой акт без использования кондома: 1:1000, но при наличии СПИД у партнера-5:1000, а при бессимптомном течении заболевания-0,7:1000. Факторами риска заражения ВИЧ при половой жизни являются: наличие крайней плоти, контакты с проститутками, отсутствие лечение у партнера (оно понижает риск передачи вируса). ВИЧ также передается через кровь и её составляющие: клетки, плазма, факторы свертывания, но не через препараты белков (альбумин) и иммуноглобулины. Скрининг на ВИЧ и тепловая обработка препаратов крови снижают риск передачи вируса через кровь.
Парентеральный путь заражения ВИЧ (укол иглой) низок: 0,25-0, 4%. Риск заражения через слизистые оболочки очень низок: 0,09% (9:100 000). Кроме того: передача ВИЧ посредством брызг, аэрозолей, через дефекты кожи, неповрежденную кожу невозможна, а в секретах тела (слезы, слюна, моча) концентрация ВИЧ очень низка и его передача также практически невозможна. Нет данных, указывающих на роль насекомых в передаче ВИЧ. Контакты с больным, связанные с уходом за ним, общение в домашнем кругу не ведут к инфицированию ВИЧ. Лечение и предупреждение инфекции
Первым средством, зарегистрированным для лечения ВИЧ инфекции был ЗИДОВУДИН (азидотимидин). Он подавляет активность фермента ВИЧ: обратной транскриптазы, тем самым снижая скорость репликации вируса, что, в свою очередь, снижает частоту и тяжесть оппортунистических инфекций и раннюю смертность больных. Лечение взрослых и детей старше 3 месяцев со СПИД и иммуносупрессией приводило к снижению количества антигена ВИЧ (р24) в сыворотке и кратковременному (около 2 месяцев) нарастанию количества СД 4 (+) клеток. Дозы варьировали от 500-600 мг до 1500 мг. Побочные действия включали: анемию, нейтропению, тошноту, головную боль. Повышение дозы З. не приводило к увеличению его эффекта.
Альтернативой З. при его непереносимости или неэффективности могут быть диданозин, ламивудин и залцитабин. В последние годы в клиническую практику внедрены новые лекарственные препараты-ингибиторы протеаз: саквинавир, ритонавир, индинавир (криксиван), нелфинавир, а также ненуклеозидные ингибиторы обратной транскриптазы: невирапин и делвирдин. Сегодня целью лечения является полное подавление репликации вируса, что предотвращает прогрессирование инфекции, снижает возможность мутаций, ответственных за развитие устойчивости вируса к лекарственным препаратам и неэффективность лечения. К началу 1997 года большинство специалистов начали пребегать к более активной тактике лечения: “тройной“ терапии препаратами различных групп (Приложение 4). К недостаткам этих рекомендаций относятся сложность схем лечения (больным приходится принимать ежедневно по 20 таблеток и более), его высокая стоимость (10-12 тыс. долл. США в год), частые побочные эффекты. Оппортунистические инфекции
В комплексе СПИД наиболее часто встречается пневмоцистная инфекция, которая характеризуется высокой смертностью (5-20%) и высоким уровнем рецидива (без соответствующей профилактики). Лечение: бисептол (сульфаметоксазол и триметоприм), что может вызвать гипербилирубинемию с ядерной желтухой у новорожденных. Но риск инфекции для здоровья беременной значительно превосходит таковой для плода.
При герпетической инфекции рекомендуется ацикловир 0,2 5 раз/сут per os, при ротоглоточном или влагалищном кандидозе-кетоконазол (0,2/сут с контролем функций печени) или флуконазол (0,1/сут). Токсоплазмоз проявляется у беременных гипертермией и симптомами со стороны ЦНС, возможно мертворождение и уродства у плода (мозг, глаза, слух). Рекомендуется проведение серологического скрининга. При сероконверсии или повышении титра антител (острый Т.) необходимо лечение: сульфадиазин (1,0 4 раза per os) или пириметамин изоэтионат (изредка возможна ядерная желтуха) по 25-50 мг/сут 1 раз per os. Цитомегаловирусная инфекция у беременных может проявляться ретинитом, приводящим к слепоте, а также колитом, эзофагитом, пневмонитом, энцефалитом, и требует лечения ганцикловиром в дозе 5 мг/кг 2 раза в сутки в/в (за 1 час) в течение 2 недель. Важной оппортунистической инфекцией является и туберкулез, также требующий лечения (изониазид, рифампицин, этамбутол). ВИЧ инфекция при беременности Влияние на беременность: У женщин клинической категории А исходы беременности не отличаются от исходов у неинфицированных женщин. Чем тяжелее заболевание, чем выше его стадия, тем более вероятны осложнения беременности.
Перинатальная передача ВИЧ: Вертикальная передача составляет 17-25% и осуществляется: трансплацентарно, в родах, через грудное молоко. Выявление инфицированных новорожденных до 18 месяцев жизни возможно лишь определением антигена (р24), ПЦР или культуральным методом, т. к. IgG от матери может определяться в крови ребёнка до 15 месяцев после рождения.
Факторы риска: стадия заболевания (клиническая категория); вирусная нагрузка: количество частиц вируса в единице объёма; иммунный статус: количество СД 4 (+) лимфоцитов; родоразрешение до 34 недель; способ родоразрешения: кесарево сечение снижает риск инфицирования новорождженного до 6-8%; противовирусное лечение снижает риск инфицирования новорожденного до 6-8%. Ведение беременных Все женщины, планирующие беременность, должны пройти скриннинг на ВИЧ. Обратить внимание на возможные клинические проявления ВИЧ инфекции. Выявить возможные ИППП. Выявление туберкулёза: папула равная или более 5 мм считается положительной пробой. Провести цитологическое исследование шейки матки на наличие злокачественных изменений Наблюдение за иммунологическим статусом каждый триместр: иммуноглобулины, СД 4 и СД 8 лимфоциты Профилактическое лечение зидовудином (азидотимидин): при беременности с 14 недель через рот по 100 мг 5 раз в сутки. Для плода З. безопасен; в родах: внутривенно 2 мг/кг в течение часа, далее 1 мг/кг/час до родоразрешения; новорожденным: 2 мг/кг через 6 часов per os в течение 6 недель.
Родоразрешение консервативное: кесарево сечение для снижения риска перинатальной передачи не рекомендуется После родов: Новорожденный остаётся с матерью Кормление грудью не рекомендуется До уточнения факта инфицирования новорожденного не проводить вакцинацию живой вакциной Выделение культуры вируса, положительные данные ПЦР или наличие антигена являются доказательством ВИЧ инфекции в любом возрасте Уровень послеродовых инфекционных осложнений у ВИЧ инфицированных родильниц не превышает таковой у неинфицированных
Риск передачи ВИЧ-инфекции медицинскому персоналу низок: среди 4 тыс. медработников, имевших тесный контакт с ВИЧ инфицированными пациентами (1000 из них с парентеральной инокуляцией) риск внутрибольничной передачи составил 0,1% в год. При парентеральной инокуляции риск заражения оказался менее 1% (4 случая на 1000). Риск для хирурга составляет 1:4500-1:130 000. Для сравнения: риск заражения вирусом гепатита Б после укола иглой составляет 10-35%. Показано, что значительный риск заражения существует при глубоком ранении тканей, при ранении предметом со следами крови инфицированного пациента, при контакте с кровью во время пункции иглой артерии или вены пациента с ВИЧ, при контакте с кровью пациента, умершего от ВИЧ инфекции в последующие 2 месяца. Как и при работе с любыми инфицированными секретами тела рекомендуется ношение перчаток, масок, защитных очков, халатов, частое мытье рук. Отходы маркируются. Возможно обследование медперсонала на ВИЧ инфекцию и проведение профилактики З. Гинекологические аспекты ВИЧ инфекции
У женщин с ВИЧ инфекцией дисплазия (интраэпителиальная неоплазия) шейки матки встречается в 5 раз чаще, а тяжесть дисплазии соответствует степени иммуносупрессии (количеству СД 4 клеток). При выявлении поражений шейки у ВИЧ инфицированных женщин мазок с окраской по Папаниколау является более точным методом диагностики в сравнении с кольпоскопией. У ВИЧ инфицированных чаще наблюдается прогрессирование дисплазии шейки матки и её рецидив после хирургического лечения, что также зависит от степени иммуносупрессии.
Нарушения иммунной защиты на уровне эндометрия приводят к повышению частоты воспалительных заболеваний органов малого таза у женщин с ВИЧ инфекцией. У заболевших чаще приходится прибегать к хирургическому методу лечения. В группе женщин с ВЗМТ целесообразен скрининг на ВИЧ. Частым заболеванием (до 24%) при ВИЧ инфицировании является влагалищный кандидоз. У лиц с тяжелой иммуносупрессией он часто является первым симптомом прогрессирования заболевания, его перехода в стадию СПИД. Контрацепция
Кондом из латекса является надежным методом предупреждения ВИЧ инфицирования, но не беременности. Наиболее эффективные методы контрацепции у ВИЧ инфицированных женщин — стероидные гормоны и стерилизация. ВМС не рекомендуются ввиду высокой вероятности инфекционных осложнений. Ввиду ненадежности также не рекомендуются к применению прерванное половое сношение и метод периодического воздержания.
ТРИХОМОНИАЗ.
Простейшее T. vaginalis, вызывающее это заболевание, впервые описано в 1836 г. Трихомониаз составляет примерно четверть от всех клинически явных инфекций влагалища, а T. vaginalis может присутствовать у женщин без симптомов вагинита. В целом заболевание встречается с частотой 3-5%. Примерно половина женщин с T. vaginalis не имеет симптомов заболевания, но у 30% из этой половины в течение 6 месяцев появляются симптомы заболевания. Выявление положительной культуры влагалищной трихомонады имеет достоверную связь с количеством половых партнёров и наличием бактериального вагиноза (БВ), но не связана с возрастом, днём менструального цикла, методом контрацепции, приёмом антибиотиков, частотой половых актов.
Симптомами заболевания являются выделения из влагалища серого (46%), белого (36%) или жёлто-зелёного цвета (10%), имеющие гомогенный водянистый (12-34%) или сметанообразный характер, дурной запах и рН более 4,5. Часто при кольпоскопии можно видеть точечные кровоизлияния в слизистую шейки матки, т.н. «клубника» или «укусы блох».
Симптомы заболевания вариабельны и не являются надёжным основанием для постановки диагноза. Чаще всего клинический диагноз может быть подтверждён при микроскопии влажного мазка, приготовленного путём смешивания на предметном стекле капли выделений из влагалища с несколькими каплями физраствора. Поскольку трихомонада может вызывать значительную полиморфоядерную инфильтрацию, которая маскирует её присутствие, необходимо изучать области мазка с небольшим количеством лейкоцитов. В свежих мазках трихомонада обычно хорошо заметна, благодаря очень активным движениям своих жгутиков. Чувствительность метода влажного мазка колеблется от 42% до 92%. У опытного специалиста чувствительность метода составляет 80% в сравнении с культурой, но если выполнять процедуру наспех, то чувствительность не превышает 50%.
Культивирование трихомонад не является сложным, но требуются специальные среды, такие как Дайамонда или Купферберга. Капля выделений (можно использовать осадок мочи, что предпочтительно у мужчин) помещается в питательный бульон, который инкубируется. Ежедневно в течение 5 дней капля среды исследуется под микроскопом до появления подвижных трихомнад. Несмотря на доступность, в клинической практике метод культуры используется редко. Диагностика трихомониаза возможна при микроскопии мазка, окрашенного по Папаниколау (или по Граму), но чувствительность метода невысока: 52-67%.
В последние годы появились новые методы диагностики заболевания: моноклональные антитела, иммуносорбция (ELISA), латекс агглютинация. Однако, недолгое использование в клинике не даёт возможности окончательно высказаться об их надёжности.
Единственным эффективным лечением трихомониаза является применение метронидазола (трихопол, флагил, клион) или производных 5-нитроимидазола: тинидазол(фазижин), орнидазол(тиберал). В данных обширных исследований опубликованных в 1993 году указывается, что приём метронидазола при беременности не приводит к росту врождённых уродств у потомства. Выяснено, что лечение однократной дозой в 2,0 столь же эффективно, как и стандартный 7-дневный курс (250 мг трижды в день). Уровень излеченности при каждом режиме одинаков и составляет 86-97%. Рекомендуется и лечение полового партнёра женщины, больной трихомониазом. Лечение проводится при наличии трихомонад в половых путях даже при отсутствии симптомов. Половая жизнь во время лечения не рекомендуется.
При лечении метронидазолом иногда отмечаются: головная боль, металлический или горький привкус, тошнота и рвота. Перед проведением повторного курса рекомендуется подсчёт лейкоцитов крови. На период лечения и один день после него употребление алкоголя следует исключить. Ввиду низкой эффективности местных форм лечения гель с метронидазолом, использующийся для лечения БВ, применять не следует. При отсутствии после лечения симптомов заболевания повторное исследование на наличие трихомонад не проводится. Все лекарства, повышающие активность микросомальных ферментов печени (фенитоин, фенобарбитал), ускоряют выведение метронидазола.
Не следует назначать метронидазол в первый триместр беременности. Для временного облегчения симптомов в этот период возможно местное применение клотримазола (100 мг во влагалище), хотя уровень излеченности при его применении относительно низок: 48-66%. При сроке беременности более 12 недель рекомендуется лечение метронидазолом в дозе 2,0 однократно.
При неэффективности лечения в стандартных дозах метронидазол назначается по 500 мг дважды в день в течение 7 дней. При неэффективности этой схемы лечения препарат назначается в дозе 2,0 однократно в течение 3-5 дней. При отсутствии эффекта от этой дозы требуется назначение препарата по 500-750 мг 4 раза в сутки в течение 7-10 дней. При повторном назначении высоких доз необходимо оценить клеточный состав крови. Дозы свыше 3 г/сутки связаны с высоким риском серьёзных побочных действий препарата: необратимые неврологические изменения. Дополнительное в/в введение препарата не улучшает результаты лечения.
Trichomonas vaginalis, сама по себе, не связана со злокачественными заболеваниями половых органов, бесплодием, абортами или эндометритом. Однако, являясь заболеванием, передающимся половым путём, она указывает на вероятность наличия других подобных заболеваний. Трихомониаз связан с наличием БВ, который сочетается с некоторыми заболеваниями в акушерстве и гинекологии. Однако, связан ли трихомониаз с такими осложнениями беременности, как преждевременное излитие ококлоплодных вод или преждевременные роды остаётся неясным, и сможет ли лечение предотвратить эти осложнения беременности — неизвестно.
Эффективной альтернативы лечению трихомониаза метронидазолом не существует. Однако, в последние годы появились препараты, по эффективности сравнимые с метронидазолом. Тинидазол: а) 0,5 через 15 минут в течение 1 часа (всего 2,0), б) 0,5 дважды в день в течение недели, в) 2,0 однократно два дня (4,0). Орнидазол: а) Однократно 1,5, б) 0,5 дважды в день 5 дней (5,0). Ниморазол: а) 0,5 дважды в день 6 дней, б) Однократно 2,0. В России диспансеризация больных трихомониазом осуществляется на основании приказа МЗ РФ N286 от 07.12.93.
КАНДИДОЗ.
Грибы — являются обычной флорой нижних половых путей женщины. Они присутствуют у 22% женщин без симптомов заболевания, и у 39% с симптомами вульвовагинита. Подсчитано, что 75% женщин в течение жизни будут иметь хотя бы один эпизод грибкового вульвовагинита, а 40-45%- два или более эпизодов. Наиболее часто из половых путей выделяется Candida albicans (81%-95%) и другие виды кандид (Candida globrata). Факторами, предрасполагающими к росту кандид во влагалище, являются глюкозурия, сахарный диабет, беременность, ожирение, лечение антибиотиками, стероидами или иммунодепрессантами. Беременность связана с ростом носительства, повышенной чувствительностью к инфекции и низкой эффективностью лечения. Антибиотики (ампициллин, тетрациклины, цефалоспорины), угнетая нормальную бактериальную флору, способствуют оппортунистической колонизации влагалища грибами. Гормональные контрацептивы с высокими дозами гормонов повышают риск колонизации влагалища грибами, но частота клинических форм инфекции не меняется. Ношение тесно облегающего нижнего белья, повышая температуру и влажность у поверхности тела, способствует развитию грибковых заболеваний.
Половая передача инфекции остаётся под вопросом. Хотя повышение инфицирования полового партнёра (в 4 раза) женщины с грибковой инфекцией и влияние на это частоты половых контактов поддерживают это предположение, но имеются также и веские контраргументы: а) нет прямой связи между грибковой инфекцией и другими ИППП, б) нет различий в частоте заболевания у пациентов с ИППП и без них, в) нет данных о том, что лечение мужчины влияет на течение заболевания у женщины. В настоящее время считается, что лечение полового партнёра женщины с грибковой инфекцией влагалища не является обязательным. Лечение требуется только мужчинам с клиническими проявлениями инфекции: явления баланита с местным зудом и раздражением. Несмотря на широко распространённые мнения, протирание ануса после дефекации в направлении сзади-вперёд, использование гигиенических прокладок, вид ткани, диета, стресс не влияют на частоту грибкового вульвовагинита.
Типичные проявления влагалищного кандидоза: покраснение тканей вульвы и влагалища, шелушение, отёк, экскориации и выступающие над поверхностью эпителия белые или жёлтые, с трудом снимающиеся налёты, отмечены только у 38-60% женщин с положительными результатами культуры C. albicans. Можно подтвердить диагноз, наблюдая мицелий или псевдогифе при прямой микроскопии после обработки препарата 10% КОН, чему часто препятствует наличие клеточного детрита, к тому же метод выявляет не более трети женщин с наличием грибов в половых путях по данным культуры. Несколько лучшие результаты даёт окрашивание препарата по Граму, но около половины женщин с положительной культурой не могут быть выявлены этим методом. Метод культуры выявляет другие виды кандид (C. globrata, C. tropicalis), которые обнаруживаются в 10-23-35% всех случаев грибковой инфекции, труднее поддаются лечению и чаще рецидивируют.
Лечение острых грибковых инфекций приводит к устранению симптомов заболевания и исчезновению грибов из половых путей в 80-90% случаев, но рецидивы инфекции остаются проблемой. Клотримазол имеет одинаковую лечебную эффективность с нистатином, но может применяться более короткими курсами.
Рекомендуемые режимы лечения грибкового вульвовагинита
– Бутоконазол 2% крем 5,0 во влагалище в течение 3 дней — Клотримазол 1% крем 5,0 во влагалище 7-14 дней — Клотримазол (или миконазол) 100 мг влагалищные таблетки в течение 7 дней или по 2 таблетки (200 мг) в течение 3 дней — Клотримазол 500 мг влагалищные таблетки однократно — Миконазол 2% крем 5,0 во влагалище в течение 7 дней — Тиоконазол (Вагистат) 6,5% мазь 5,0 во влагалище однократно — Терконазол (Теразол) 0,4% крем 5,0 во влагалище в течение 7 дней или 0,8% крем в течение 3 дней — Терконазол 80 мг свечи во влагалище в течение 3 дней — Кетоконазол через рот 200 мг дважды в день в течение 5 дней или 200 мг три раза в день в течение 3 дней (устранение кишечного резервуара инфекции) — Флуконазол (дефлюкан) через рот 150 мг однократно или 50 мг 3 дня
Флуконазол не имеет явных преимуществ перед местной терапией при лечении неосложнённых грибковых вульвовагинитов, поэтому рассматривается как препарат резерва для случаев, устойчивых к лечению.
В случаях клинически явного кандидоза можно использовать 1% раствор генцианвиолета, который даёт быстрое клиническое улучшение, но при постоянном применении может вызвать значительную сухость тканей и зуд. Недорогим и достаточно эффектвным методом местного лечения является назначение борной кислоты в виде порошка в желатиновых капсулах: 600 мг в течение 14 дней. Это лечение не стоит применять у беременных. Устранить кандидиаз при беременности труднее, поэтому рекомендуется местное назначение азолов (клотри-, мико-, бутоко-, терконазол) в течение 7 дней.
При частых рецидивах заболевания (4 раза в год) рекомендуется лечение кетоконазолом в дозе 400 мг в течение 14 дней с последующим длительным применением клотримазола (местно раз в неделю) или кетоконазола (100 мг в день до 6 месяцев или по 400 мг 5 дней ежемесячно). Целесообразно рассмотреть возможность ВИЧ инфекции. Лечение полового партнёра женщины с грибковым вульвовагинитом или самой женщины при отсутствии клинических проявлений заболевания не требуется.
Бактериальный вагиноз. В 1955 г. Гарднер и Дьюк описали клинический синдром вагинита с характерными (85% случаев) серыми гомогенными выделениями с запахом, высоким рН влагалища (5-5.5) без присутствия грибов или трихомонады. При исследовании влажного мазка были найдены характерные эпителиальные клетки, названные «ключевыми». У четверти женщин влагалищный секрет был пенистым. Количество лейкоцитов было нормальным. Из влагалищных выделений был выделен микроорганизм, называемый теперь Gardnerella vaginalis. В последующие 20 лет была подтверждена связь этого характерного синдрома с наличием G. vaginalis, хотя указывалось, что часто этот микроорганизм может присутствовать в половых путях женщин, не имеющих симптомов заболевания.
В настоящее время общепризнано, что БВ является результатом сдвига в составе бактериальной флоры от нормальных, продуцирующих пероксидазу, лактобацилл к полимикробным ассоциациям, содержащих микроорганизмы в высоких концентрациях, которые представлены анаэробами, бактероидами, пептострептококками, группой мобилункус, гарднереллой, микоплазмами. По последним данным, культура G. vaginalis выделяется у 45-98% женщин с БВ и у 16-48% здоровых женщин, пептострептококки, соответственно, у 29-63% и у 5-27% контроля, Micoplasma hominis-у 58-76% и у 20% контроля, мобилункус- 51% и 0%. В то же время лактобациллы выделены у 9-38% женщин с БВ и у 68-90% здоровых женщин. Лактобациллы, выделяющие пероксидазу, найдены в 6% случаев БВ и у 96% здоровых женщин. Анаэробные лактобациллы, не выделяющие пероксидазу, обнаружены в 36% случаев БВ и только в 4% нормы.
В настоящее время БВ признан часто встречающимся заболеванием. Хотя отсутствие стандартных диагностических критериев затрудняет изучение его эпидемиологии, подсчитано, что БВ встречается у 15% женщин общей популяции, у 10-30% беременных, 5-25% молодых женщин в возрасте 20-25 лет. В клиниках венерических болезней БВ встречается у 12-61% пациентов. Общепринятым является мнение, что БВ не является ИППП.
От 1/3 до 3/4 женщин с БВ (50%) не имеет симптомов заболевания. Основным симптомом являются выделения из влагалища, которые встречаются чаще, чем зуд. Некоторые пациенты могут отмечать неприятный запах выделений, который усиливается после полового контакта. При осмотре типичные выделения описываются как беловатые, сливкообразные или молочные, гомогенные (нормальный секрет выглядит гетерогенным), часто отчётливо видимые в области преддверия. Явления раздражения выражены меньше, чем при трихомониазе и кандидозе. Диагноз БВ основан на характеристике выделений, наличии высокого рН (более 4,5), «аминном»(рыбном) запахе при контакте выделений с калийной щёлочью (10% КОН), ключевых клеток, которые являются эпителиальными клетками столь густо обложенные бактериями, что их границы различаются с трудом. Клетки влагалищного эпителия с небольшим количеством бактерий и отчётливыми границами не должны рассматриваться как «ключевые». Несмотря на вероятную роль анаэробов в этиологии заболевания, нет необходимости в выделении их методом культуры. Также не имеет диагностической значимости выделение культуры G. vaginalis из влагалищных выделений.
В диагностике БВ может быть использована микроскопия влагалищных выделений, окрашенных по Граму. У пациентов с БВ отмечается обильная смешанная бактериальная флора и немного лактобацилл. Ясно различимы ключевые клетки. У здоровых женщин бактерий мало, а доминируют лактобациллы. У значительного числа пациентов микроскопия мазка выявляет промежуточный тип микрофлоры. У этих пациентов возможно развитие БВ, а при его наличии-спонтанное выздоровление. При микроскопии выделений, окрашенных по Граму, с целью диагностики БВ выделяют три типа бактерий: лактобациллы, видимые как большие грам-положительные палочки; Gardnerella и Bacteroides-маленькие грам-отрицательные или вариабельные по окраске палочки; Mobiluncus-изогнутые грам-отрицательные или вариабельные по окраске палочки. Метод имеет чувствительность 62-100% и положительную прогностическую ценность 76-100%.
Лечение. Рекомендуемый режим: метронидазол 500 мг дважды в день 7 дней. Следует помнить, что пациент должен воздерживаться от употребления алкоголя в течение лечения и 24 часа после его завершения. Уровень излеченности-78-96%.
Альтернативные режимы:
– метронидазол 2,0 однократно. Уровень излеченности составляет 72-84%. — клиндамицин (далацин) крем 2% 5,0 (один полный аппликатор) во влагалище перед сном в течение 7 дней. Уровень излеченности составляет 78-94%. — метронидазол гель 0,75% 5,0 (один полный аппликатор) во влагалище дважды в день в течение 5 дней. Уровень излеченности-87%. — клиндамицин 300 мг через рот дважды в день в течение 7 дней. Уровень излеченности 94%.
Лечение полового партнёра женщины с БВ не рекомендуется, т.к. не влияет на уровень рецидива заболевания. Метронидазол не следует назначать в первый триместр беременности, когда следует предпочесть лечением кремом клиндамицина. В более поздние сроки беременности допустимо лечение любым методом, но предпочтительным является местное лечение. Лечение больных с ВИЧ инфекцией не отличается от стандартного. Эффективного метода предупреждения БВ не существует. У беременных наличие БВ повышает риск преждевременного излития околоплодных вод, преждевременных родов, послеоперационных и послеродовых инфекционных осложнений. Однако польза от лечения (16-26 недель) для улучшения исходов беременности остаётся недоказанной. Выявление и лечение БВ целесообразно у беременных с высоким риском преждевременных родов (анамнез, клинические проявления). Рутинный скрининг и лечение БВ при неосложнённом течение беременности не рекомендуется. У небеременных БВ связывают с повышением риска ОВЗМТ. Лечение БВ перед проведением искусственного аборта в I триместре беременности существенно снижало частоту ОВЗМТ после аборта.
ПРИЛОЖЕНИЕ 1 ИНФЕКЦИИ, ПЕРЕДАЮЩИЕСЯ ПОЛОВЫМ ПУТЕМ БАКТЕРИИ Chlamydia trachomatis
Neisseria gonorrhaeae
Gardnerella vaginalis
Treponema pallidum
Гемолитические стрептококки группы » В »
Haemophilus ducreyi
Calymmatobacterium granulomatosis
Shigella spp
МИКОПЛАЗМЫ Ureaplasma urealyticum
Mycoplasma hominis ПАРАЗИТЫ Sarcoptes scabiei
Phthirus pubis ВИРУСЫ Herpes simplex ( типы 1 и 2 )
Papillomavirus
Гепатит А и Б
Цитомегаловирус
ВИЧ ( типы 1 и 2 )
Т — клеточная лейкемия ( тип 1 )
ПРОСТЕЙШИЕ Entamoeba histolytica
Giardia lamblia
Trichomonas vaginalis ГРИБЫ Candida albicans
ПРИЛОЖЕНИЕ 2. РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ СИФИЛИСА.
1. Первичный и вторичный сифилис
Рекомендуемый режим: Бензатин пенициллин G (экстенциллин, ретарпен) 2,4 млн. ед. в / м однократно. При аллергии к пенициллину ( для небеременных ): в течение 2 недель per os — Доксициклин 100 мг 2 раза в сутки — Тетрациклин 500 мг 4 раза в сутки — Эритромицин 500 мг 4 раза в сутки
2. Латентный сифилис
Рекомендуемый режим: Ранний латентный сифилис ( менее 1 года ) — Бензатин пенициллин G 2,4 млн. ед. в / м однократно
Поздний латентный сифилис ( более 1 года ) — Бензатин пенициллин G еженедельно трёхкратно в / м по 2,4 млн. ед. до общей дозы 7,2 млн. ед.
При аллергии к пенициллину ( для небеременных ): в течение 2 недель при раннем, в течение 4 недель при позднем латентном сифилисе
Доксициклин 100 мг 2 раза или Тетрациклин 500 мг 4 раза в сутки.
3. Поздний сифилис
Рекомендуемый режим ( без нейросифилиса ): Бензатин пенициллин еженедельно трёхкратно в / м по 2,4 млн. ед. до общей дозы 7,2 млн. ед.
При аллергии к пенициллину: то же, что для позднего латентного сифилиса.
4. Нейросифилис
Рекомендуемый режим: водный раствор кристаллического пенициллина G в дозе 12 — 24 млн.ед. в сутки, вводимый каждые 4 часа в / в по 2 — 4 млн. ед. 10 — 14 дней.
Альтернативный режим ( для контролируемых пациентов ): прокаин пенициллин в / м ежедневно по 2,4 млн. ед. и пробенецид по 500 мг 4 раза в день per os в течение 10 — 14 дней.
5. Сифилис при беременности
Рекомендуемый режим: лечение всех стадий сифилиса проводится только пенициллином. Отдельные специалисты рекомендуют дополнительное лечение в виде второй инъекции бензатин пенициллина в / м в дозе 2,4 млн. ед. через 1 неделю после первой инъекции. Это особенно важно для жещин, начавших лечение в III триместре, и для тех, у которых во время беременности развился вторичный сифилис.
При аллергии к пенициллину беременные должны пройти десенситизацию и получить лечение пенициллином.
6. Сифилис у ВИЧ — инфицированных пациентов
При первичном и вторичном сифилисерекомендуется в / м введение 2,4 млн. ед. бензатин пенициллина. Отдельные специалисты рекомендуют повторные инъекции пенициллина, как при позднем сифилисе. При аллергии к пенициллину следует провести десенситизацию и начать лечение пенициллином.
При латентном сифилисе и нормальных результатах исследования спиномозговой жидкости рекомендуется лечение бензатин пенициллином в общей дозе 7,2 млн. ед., разделённой на три введения по 2,4 млн. ед. еженедельно.
ПРИЛОЖЕНИЕ 3. КЛАССИФИКАЦИЯ ВИЧ ИНФЕКЦИИ. Категория по содержанию Клиническая категория СД 4 ( + ) Т — лимфоцитов A B C Более 500 / мкл — более 29% A1 B1 C1 200 — 499 / мкл — 14 — 28% A2 B2 C2 менее 200 / мкл — менее 14% A3 B3 C3
Клиническая категория А: острая (первичная) ВИЧ инфекция, персистирующая генерализованная лимфоаденопатия, и пациенты без симптомов ВИЧ — инфекции
Клиническая категория В: симптомные состояния, встречающиеся при ВИЧ инфицировании, но не состояния, входящие в категории А или С
– кандидоз вульвы и влагалища: персистирующий, частый, устойчивый к лечению
— кандидоз ротоглотки
— дисплазия шейки матки умеренная или тяжелая
— общие симптомы: лихорадка более 38,5* или понос, длящиеся более 1 мес
— лейкоплакия волосистых частей тела, рта
— герпес: два и более эпизода и занимающий более 1 дерматома
— идиопатическая тромбоцитопеническая пурпура
— листериоз
— воспалительные заболевания малого таза, особенно, осложненные тубо-овариальным абсцессом
— периферическая нейропатия
Клиническая категория С: состояния, указывающие на СПИД
— кандидоз бронхов, трахеи, легких
— кандидоз пищевода
— инвазивный рак шейки матки
— кокцидиоидомикозы распространенные или внелегочные
— криптококкоз внелегочный
— криптоспоридиоз хронический кишечный (более 1 мес)
— цитомегаловирусная инфекция, кроме печени, селезенки или лимфоузлов
— цитомегаловирусный ретинит с потерей зрения
— энцефалопатия
— герпес: хронические язвы (более 1 мес), поражения бронхов,легких, пищевода
— гистоплазмозис распространенный или внелегочный
— изоспориазис хронический кишечный (более 1 мес)
— саркома Капоши
— лимфома Буркитта
— лимома имунобластическая
— лимфома мозга, первичная
— туберкулез любой локализации
— пневмоцистная пневмония
— пневмония возвратная
— прогрессирующая множественная лейкоэнцефалопатия
— сальмонеллез возвратный, септицемия
— токсоплазмоз мозга
— синдром усталости
ПРИЛОЖЕНИЕ 4.
Практические рекомендации по лечению ВИЧ инфекции
(университет Джона Хопкинса, США, май 1997 г.)
Когда начинать лечение: · острая ВИЧ инфекция: в остром периоде или в течение 6 месячного периода сероконверсии, — хроническая ВИЧ инфекция: при уровне РНК ВИЧ более 10 тыс. копий/мл или числе СД 4 (+) лимфоцитов менее 500 кл/мм3.
С чего начинать лечение: 1. Предпочтительная схема (доказана наиболее стойкая и выраженная антивирусная активность у большинства больных) — 2 НИОТ (нуклеозидный ингибитор обратной транскриптазы): З. и ламивудин; З. и диданозин; З. и залцитабин; ламивудин или диданозин со ставудином и какой-нибудь из ингибиторов протеаз (ретиновир, индинавир, нелфинавир).
2. Альтернативная схема (менее эффективна, чем предпочтительная — 2 НИОТ в сочетании с невирапином.
Противопоказано: монотерапия любым препаратом, а также З. со ставудином, диданозин с залцитабином, залцитабин со ставудином.
Когда изменять схему лечения: · при неэффективности лечения: уровень РНК ВИЧ более 500 копий/мл через 4-6 мес. от начала лечения.
— в случае токсичности или непереносимости лекарственных препаратов.
— при появлении новых, более эффективных лекарственных препаратов.
Как изменять схему лечения при его неэффективности:
Прежняя схема Новая схема (два и более новых препаратов) 2 НИОТ с ингибитором протеаз 2 новых НИОТ с новым ингибитором протеаз (не менять ретинавир на индинавир)
2 новых НИОТ с невирапином
Новый НИОТ, новый ингибитор протеаз, невирапин
2 новых ингибитора протеаз и НИОТ
2 НИОТ с невирапином 2 новых НИОТ с ингибитором протеаз
2 НИОТ 2 новых НИОТ с ингибитором протеаз или невирапином.