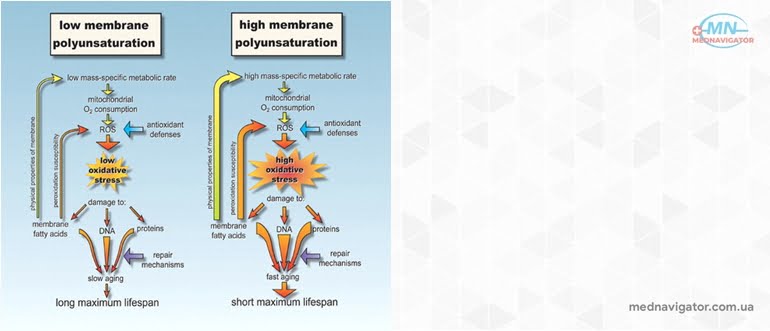
Действительно, вопрос о наличие процессов старения у постоянно делящихся клеток, например, бактерий, до сих пор остается дискуссионным, несмотря на то, что был поставлен еще в прошлом столетии. Согласно основным положениям, постулированным А. Вейсманом, естественное старение отсутствует у одноклеточных организмов. Эволюционное противоречие между необходимостью специализации клеток и сохранением их бессмертия путем неограниченного деления привело к необходимости разделения клеток на соматические, которым было позволено дифференцироваться и стареть, и бессмертные зародышевые или половые [1]. Существование огромных и сложных многоклеточных организмов, содержащих многие триллионы соматических клеток, в сущности, направлено к тому, чтобы обеспечить бессмертие половых клеток. Взгляды Вейсмана нашли убедительное подтверждение в исследованиях Л. Хейфлика, установившего, что нормальные соматические клетки человека имеют ограниченный митотический потенциал и конечную продолжительность жизни [ 18 ]. Естественное старение, как представляется очевидным, присуще и бесконечно делящимся клеткам, но, постоянно воспроизводя свою генетическую информацию и свои сравнительно несложные структуры, они умеют делать его незаметным. Старение же многоклеточного организма складывается из падения пролиферативного потенциала его стволовых клеток и старения и смерти его полностью дифференцированных клеток. Этот сложнейший системный процесс, ход которого определяется взаимодействием различных клеточных групп, безусловно, не следует упрощать. Различия во времени жизни каждого из этих клеточных ансамблей, как делящихся, так и уже неделящихся клеток, могут быть огромными. Фибробласты человека не успевают исчерпать лимит Хейфлика за время его жизни, тогда, как нейроны у взрослых не пролиферируют. Принципиальное значение имеет, однако, сам факт ограниченности митотического потенциала для любой нормальной соматической клетки многоклеточного организма, и не так существенно, какая из клеточных групп имеет критическое значение для продолжительности жизни индивидуума или особи. Самостоятельное значение, возможно, имеет само снижение пролиферативной активности после прохождения определенного числа клеточных удвоений, а также сохраняемая у нормальных клеток способность к восприятию действия агентов регулирующих скорость деления. Конечная длительность жизни клеточных штаммов, до некоторой степени, отражает процесс старения in vivo, а многие изменения, наблюдаемые при их старении, сходны с теми, что имеют место в тканях. В пользу репликативной теории старения приводятся данные о наличие корреляции между продолжительностью жизни разных видов животных и сроком жизни их клеток in vitro [ 25, 28 ] Незначительное число делений проходят клетки больных прогерией ( синдром Вернера ). Имеется, однако, работа, в которой сведения об обратной корреляции между репликативным потенциалом клеток и возрастом их доноров оспорены [ 57 ]. К настоящему времени уже многое известно о механизмах, с помощью которых соматические клетки ограничивают число своих делений. Находит подтверждение гипотеза А. Оловникова о роли укорочения теломерной ДНК в этом процессе [ 15, 21, 28 ] и, что весьма примечательно, уже на этой стадии существенное влияние на скорость старения оказывают свободнорадикальные процессы. Условия гипероксии резко сокращают продолжительность жизни длительно пассируемых клеток и стимулируют накопление в них характерного пигмента старения липофусцина [ 39, 56 ]. Экспозиция фибробластов в 40% кислороде приводит к повреждению и быстрой потере теломерной ДНК [ 79, 80 ]. Напротив, низкое парциальное давление кислорода увеличивает продолжительность их жизни in vitro [ 27, 84]. Антиоксидант добавленный в среду инкубации способен продлевать жизнь культуры фибробластов в зависимости от дозы [ 27 ]. Вопрос об участии активные форм кислорода в регуляции деления, дифференцировки, старения клеток и механизмах канцерогенеза уже давно дискутируется в литературе [ 6, 9, 51 ]. Недавние исследование показало, что онкогенный ras ген индуцирует генерацию оксидантов в клетке [ 41 ]. Постоянное повреждение генома оксидантами, как предполагается, может быть ответственно за превращение клеточных структур в бессмертные клеточные линии [ 51 ]. Закономерности клеточного старения удобно рассмотреть на примере высокоспециализированных клеток периферической крови, не способных к делению или делящихся достаточно редко. Срок жизни клеток крови человека варьирует в очень широких пределах от нескольких часов до нескольких лет ( табл. 1 ). Нами было установлено, что уровень удельной активности супероксиддисмутазы в различных форменных элементах крови сильно различается [ 3 ]. Сопоставление обеспеченности клеток крови супероксиддисмутазой с их способностью к экзогенной генерации супероксидных радикалов позволило проследить взаимосвязь указанных факторов со сроком жизни клеток в крови [ 4, 5, 8, 9 ]. Самая низкая активность супероксиддисмутазы наблюдается в гранулоцитах. В то же время эти клетки обладают способностью к мощной экзогенной генерации супероксидных радикалов, с помощью которых осуществляется бактерицидная функция [ 59 ]. Для этой цели расходуется большая часть кислорода потребляемого гранулоцитами. Неудивительно поэтому, что срок жизни этих клеток невелик. Стимуляция фагоцитоза, сопровождающаяся респираторным взрывом и резким усилением генерации супероксидных радикалов, в той же степени ускоряют и гибель фагоцитов [ 59 ]. Экзогенная супероксиддисмутаза увеличивает при этом выживаемость фагоцитирующих клеток до уровня отдыхающих. Наиболее высокой активностью супероксиддисмутазы обладают тромбоциты, которые, однако, экзогенно генерируют супероксидные радикалы [ 33 ], что существенно ограничивает срок их жизни. Эритроциты также характеризуются высоким уровнем супероксиддисмутазы. Эти клетки обладают очень слабой способностью к экзогенной генерации супероксидных радикалов [ 60 ], но содержат большое количество гемоглобина, постоянно взаимодействующего с кислородом и генерирующим при автоокислении в метгемоглобин супероксидные радикалы. Срок их жизни больше чем у тромбоцитов, но не очень высокий. Лимфоциты экзогенно не генерируют супероксидные радикалы [ 42 ] и имеют довольно высокий уровень супероксиддисмутазы. Вероятно, поэтому срок их жизни весьма длителен.
Бессмертие и старение на клеточном уровне: Возможное участие свободных радикалов